
Struktura, funkcje, właściwości, synteza uracylu
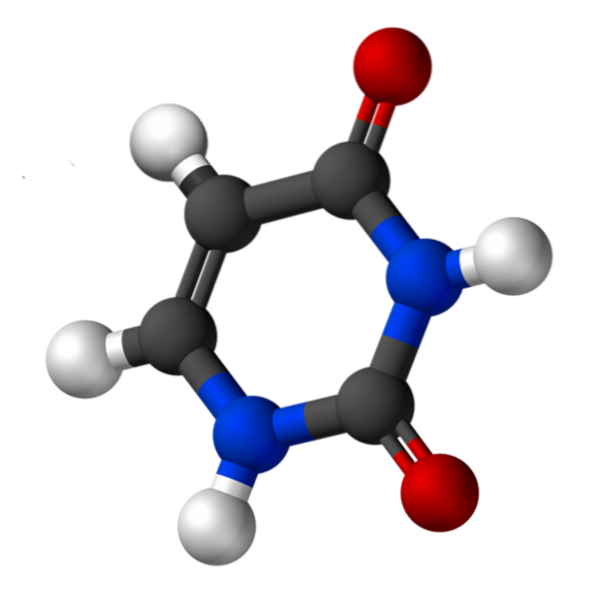
Plik uracyl Jest to zasada azotowa typu pirymidyny, występująca w kwasie rybonukleinowym (RNA). Jest to jedna z cech odróżniających RNA od kwasu dezoksyrybonukleinowego (DNA), ponieważ ten ostatni ma tyminę zamiast uracylu. Obie substancje, uracyl i tymina, różnią się tylko tym, że druga ma grupę metylową.
Z ewolucyjnego punktu widzenia zaproponowano, że RNA był pierwszą cząsteczką przechowującą informacje genetyczne i działającą jako katalizator w komórkach, przed DNA i enzymami. Z tego powodu uważa się, że uracyl odegrał kluczową rolę w ewolucji życia.
W organizmach żywych uracyl nie występuje w postaci wolnej, ale zwykle tworzy nukleotydy monofosforan (UMP), difosforan (UDP) i trifosforan (UTP). Te nukleotydy uracylowe mają różne funkcje, takie jak biosynteza RNA i glikogenu, izomeryczna przemiana cukrów i regulacja syntazy glutaminy..
Indeks artykułów
- 1 Struktura i właściwości
- 2 Biosynteza
- 2.1 Regulacja biosyntezy
- 3 Rola w biosyntezie RNA
- 4 Rola w biosyntezie cukru
- 5 Rola w izomerycznej przemianie cukrów
- 6 Rola w biosyntezie glikoprotein
- 7 Rola w regulacji syntazy glutaminy
- 8 Rola w edycji RNA
- 9 Biosynteza glukozy UDP
- 10 Glikozylaza DNA uracylu
- 11 Odnośniki
Struktura i właściwości
Uracyl, zwany 2,4-dioksypirydyną, ma wzór empiryczny C.4H.4NdwaLUBdwa, którego masa cząsteczkowa wynosi 112,09 g / mol i jest oczyszczony jako biały proszek.
Struktura urydyny to pierścień heterocykliczny z czterema atomami węgla i dwoma atomami azotu, z naprzemiennymi wiązaniami podwójnymi. Jest płaski.
Ma rozpuszczalność 50 mg / ml w 25ºC w 1M wodorotlenku sodu i pKa między 7,9 a 8,2. Długość fali, przy której występuje maksymalna absorbancja (ʎmax) mieści się w zakresie od 258 do 260 nm.
Biosynteza
Istnieje wspólna ścieżka biosyntezy nukleotydów pirymidynowych (uracyl i cytokina). Pierwszym krokiem jest biosynteza fosforanu karbamoilu z COdwa i NH4+, który jest katalizowany przez syntetazę fosforanu karbamoilu.
Pirymidyna zbudowana jest z fosforanu karboilu i asparaginianu. Obie substancje reagują i tworzą N-karbamoiloasparaginian, reakcję katalizowaną przez transkabamoilazę asparaginianową (ATCase). Zamknięcie pierścienia pirymidynowego jest spowodowane odwodnieniem katalizowanym przez dihydrootazę i wytwarza L-dihydrorotan..
L-dihydrorotan jest utleniany i przekształcany w orotan; akceptorem elektronów jest NAD+. Jest to reakcja katalizowana przez dehydrogenazę dihydroorotanu. Kolejnym krokiem jest przeniesienie grupy fosforybozylowej z pirofosforanu fosforybozylu (PRPP) do orotanu. Formy orotydylanu (OMP) i nieorganicznego pirofosforanu (PPi), katalizowane przez orotanofosforybozylotransferazę.
Ostatni etap polega na dekarboksylacji pierścienia pirymidynowego orotydylanu (OMP). Tworzy urydylan (urydyno-5'-monofosforan, UMP), który jest katalizowany przez dekarboksylazę.
Następnie, przy udziale kinazy, grupa fosforanowa jest przenoszona z ATP do UMP, tworząc UDP (urydyno-5'-difosforan). Ten ostatni powtarza się, tworząc UTP (urydyno-5'-trifosforan).
Regulacja biosyntezy
U bakterii regulacja biosyntezy pirymidyny zachodzi poprzez ujemne sprzężenie zwrotne, na poziomie transkabamoilazy asparaginianowej (ATCase).
Enzym ten jest hamowany przez CTP (cytydyno-5'-trifosforan), który jest końcowym produktem szlaku biosyntezy pirymidyny. ATCase ma podjednostki regulatorowe, które wiążą się z allosterycznym regulatorem CTP.
U zwierząt regulacja biosyntezy pirymidyny zachodzi poprzez ujemne sprzężenie zwrotne, na poziomie dwóch enzymów: 1) syntazy karbamoilofosforanowej II, która jest hamowana przez UTP i aktywowana przez ATP i PRPP; i 2) dekarboksylaza OMP, która jest hamowana przez produkt reakcji, którą katalizuje, UMP. Szybkość biosyntezy OMP różni się w zależności od dostępności PRPP.
Rola w biosyntezie RNA
Uracyl jest obecny we wszystkich typach RNA, takich jak informacyjny RNA (mRNA), transferowy RNA (tRNA) i rybosomalny RNA (rRNA). Biosynteza tych cząsteczek zachodzi w procesie zwanym transkrypcją..
Podczas transkrypcji informacje zawarte w DNA są kopiowane do RNA przez polimerazę RNA. Odwrotny proces, w którym informacja zawarta w RNA jest kopiowana do DNA, zachodzi w niektórych wirusach i roślinach poprzez odwrotną transkryptazę..
Biosynteza RNA wymaga trifosforanu nukleozydu (NTP), a mianowicie: trifosforanu urydyny (UTP), trifosforanu cytydyny (CTP), trifosforanu adeniny (ATP) i trifosforanu guaniny (GTP). Reakcja jest następująca:
(RNA)n pozostałości + NTP -> (RNA)n + 1 pozostałość + PPi
Hydroliza nieorganicznego pirofosforanu (PPi) dostarcza energii do biosyntezy RNA.
Rola w biosyntezie cukru
Estry cukrowe są bardzo powszechne w organizmach żywych. Niektóre z tych estrów to difosforany estrów nukleozydów, takie jak cukry UDP, które są bardzo liczne w komórkach. Cukry UDP uczestniczą w biosyntezie disacharydów, oligosacharydów i polisacharydów.
W roślinach biosynteza sacharozy przebiega dwoma szlakami: pierwotnym i wtórnym.
Głównym szlakiem jest transfer D-glukozy z UDP-D-glukozy do D-fruktozy z wytworzeniem sacharozy i UDP. Szlak wtórny obejmuje dwa etapy: zaczyna się od UDP-D-glukozy i fruktozo-6-fosforanu, a kończy na tworzeniu sacharozy i fosforanu..
W gruczołach sutkowych biosynteza laktozy zachodzi z UDP-D-galaktozy i glukozy.
W roślinach biosynteza celulozy odbywa się poprzez ciągłą kondensację reszt beta-D-glukozylowych, od UDP-glukozy do nieredukującego końca rosnącego łańcucha poliglukozy. Podobnie, biosynteza amylozy i amylopektyny wymaga UDP-glukozy jako substratu donora glukozy w rosnącym łańcuchu..
U zwierząt do biosyntezy glikogenu wykorzystuje się zarówno glukozę UDP, jak i glukozę ADP. Podobnie, biosynteza siarczanu chondroityny wymaga UDP-ksylozy, UDP-galaktozy i UDP-glukuronianu..
Rola w izomerycznej przemianie cukrów
Przekształcenie galaktozy w półprodukt glikolizy zachodzi na szlaku Leloir. Jeden z etapów tego szlaku jest katalizowany przez enzym UDP-galaktozo-4-epimerazę, który ułatwia wzajemną przemianę galaktozy UDP w glukozę UDP..
Rola w biosyntezie glikoprotein
Podczas biosyntezy glikoprotein białka przechodzą przez worki cis, środkowe i trans aparatu Golgiego.
Każdy z tych woreczków zawiera zestaw enzymów przetwarzających glikoproteiny. Monomery cukrowe, takie jak glukoza i galaktoza, są dodawane do oligosacharydu białkowego z UDP-heksozy i innych nukleotydów-heksozy.
Nukleotydy heksozowe są transportowane do cystern Golgiego przez antyport. Galaktoza UDP (UDP-Gal) i UDP-N-acetylogalaktozamina (UDP-GalNAc) dostają się do cystern z cytozolu poprzez wymianę na UMP.
W zbiorniku Golgiego fosfataza hydrolizuje grupę fosforanową na UDP i tworzy UMP i Pi. UDP pochodzi z reakcji katalizowanych przez galaktozylotransferazę i N-acetylogalaktozamylotransferazę. UMP utworzony przez fosfatazę służy do wymiany nukleotyd-heksoza.
Rola w regulacji syntazy glutaminy
Mechanizmem regulacyjnym syntazy glutaminy jest modyfikacja kowalencyjna, na którą składa się adenylacja, która ją inaktywuje oraz dedenylacja, która ją aktywuje. Ta kowalencyjna modyfikacja jest odwracalna i katalizowana przez adenylotransferazę..
Aktywność adenylotransferazy jest modulowana przez wiązanie białka PII, które jest regulowane przez modyfikację kowalencyjną, urydynylację.
Urydylację i deurydylację przeprowadza się przez urydylotransferazę. W tym enzymie aktywność urydylacji jest spowodowana glutaminą i fosforanem i jest aktywowana przez wiązanie alfa-ketoglutaranu i ATP z PII.
Rola w edycji RNA
Niektóre mRNA są edytowane przed translacją. W niektórych organizmach eukariotycznych, takich jak Trypanosoma brucei, istnieje edycja RNA transkryptu genu podjednostki II cytochromu oksydazy. Dzieje się to poprzez insercję reszt uracylu, reakcję katalizowaną przez końcową urydylotransferazę..
Przewodnik RNA, komplementarny do edytowanego produktu, służy jako szablon w procesie edycji. Pary zasad utworzone między początkowym transkrypcją a przewodnim RNA implikują pary zasad G = U, które nie są parami Watsona-Cricka i są powszechne w RNA..
Biosynteza glukozy UDP
W warunkach fizjologicznych biosynteza glikogenu z glukozo-1-fosforanu jest termodynamicznie niemożliwa (ΔG dodatnia). Dzięki temu przed biosyntezą następuje aktywacja glukozo-1-fosforanu (G1P). Ta reakcja łączy G1P i UTP, tworząc glukozę difosforanu urydyny (UDP-glukoza lub UDPG)..
Reakcja jest katalizowana przez pirofosforylazę UDP-glukozy i przebiega następująco:
G1P + UTP -> UDP-glukoza + 2Pi.
Zmiana energii swobodnej Gibbsa na tym etapie jest duża i ujemna (-33,5 KJ / mol). Podczas reakcji na tlen G1P atakuje atom alfa fosforu UTP i tworzy UDP-glukozę i nieorganiczny pirofosforan (PPi). Następnie PPi jest hydrolizowany przez nieorganiczną pirofosfatazę, której energia hydrolizy jest tym, co napędza ogólną reakcję.
Glukoza UDP jest substancją „wysokoenergetyczną”. Pozwala na tworzenie wiązań glikozydowych pomiędzy resztą glukozy a rosnącym łańcuchem polisacharydowym. Ta sama zasada energetyczna ma zastosowanie do reakcji, w których uczestniczą cukry UDP, takich jak biosynteza disacharydów, oligosacharydów i glikoprotein..
Glikozylaza DNA uracylu
Istnieją spontaniczne uszkodzenia DNA. Jedną z tych zmian jest spontaniczna deaminacja cytokiny, a następnie jej konwersja do uracylu. W tym przypadku naprawa odbywa się poprzez usunięcie zmodyfikowanej zasady DNA przez enzym zwany glikozylazą uracylową DNA..
Enzym uracylowa glikozylaza DNA usuwa uszkodzoną cytokinę (uracyl), wytwarzając resztę dezoksyrybozy pozbawioną zasady azotowej, zwaną miejscem AP (miejsce apurynowo-apirymidynowe).
Enzym endonukleaza AP przecina następnie szkielet fosfodiestrowy w miejscu AP, usuwając resztę cukrowo-fosforanową. Polimeraza DNA I przywraca uszkodzoną nić.
Bibliografia
- Bohinski, R. 1991. Biochemistry. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, T.M. 2000. Biochemistry. Od redakcji Reverté, Barcelona.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Cellular and Molecular biology. Od redakcji Medica Panamericana, Buenos Aires, Bogota, Caracas, Madryt, Meksyk, Sāo Paulo.
- Nelson, D. L., Cox, M. M. 2008. Lehninger-Principles of biochemistry. W.H. Freeman, Nowy Jork.
- Voet, D. i Voet, J. 2004. Biochemistry. John Wiley and Sons, USA.


Jeszcze bez komentarzy