
Określona objętość wody, powietrza, pary, azotu i gazu doskonałego
Plik określona objętość jest to intensywna właściwość charakterystyczna dla każdego elementu lub materiału. Jest definiowany matematycznie jako związek między objętością zajmowaną przez określoną ilość materii (kilogram lub gram); innymi słowy, jest odwrotnością gęstości.
Gęstość wskazuje, ile waży 1 ml materii (ciekłej, stałej, gazowej lub jednorodnej lub niejednorodnej mieszaniny), natomiast objętość właściwa odnosi się do objętości, która zajmuje 1 g (lub 1 kg). Tak więc, znając gęstość substancji, wystarczy obliczyć odwrotność, aby określić jej objętość właściwą.

Do czego odnosi się słowo „konkretny”? Gdy o jakiejś właściwości mówi się, że jest specyficzna, oznacza to, że wyraża się ją w funkcji masy, co pozwala na jej przekształcenie z właściwości ekstensywnej (zależnej od masy) w intensywną (ciągłą we wszystkich punktach układu)..
Jednostki, w których zwykle wyraża się objętość właściwą, to (m3/ Kg) lub (cm3/ g). Jednakże, chociaż ta właściwość nie zależy od masy, zależy od innych zmiennych, takich jak temperatura lub ciśnienie działające na substancję. Powoduje to, że gram substancji zajmuje większą objętość w wyższych temperaturach..
Indeks artykułów
- 1 Z wody
- 2 Z powietrza
- 3 Z pary
- 4 Azot
- 5 Idealnego gazu
- 6 Odnośniki
Z wody
Na pierwszym zdjęciu widać kroplę wody, która ma się zmieszać z powierzchnią cieczy. Ponieważ jest to naturalna substancja, jej masa zajmuje objętość jak każda inna. Ta makroskopowa objętość jest iloczynem objętości i interakcji jej cząsteczek.
Cząsteczka wody ma wzór chemiczny H.dwaLub o masie cząsteczkowej około 18 g / mol. Gęstości, które przedstawia, zależą również od temperatury, a w skali makro rozkład jego cząsteczek uważa się za możliwie jednorodny..
Mając wartości gęstości ρ w temperaturze T, do obliczenia objętości właściwej wody w stanie ciekłym wystarczy zastosować następujący wzór:
v = (1 / ρ)
Oblicza się ją eksperymentalnie określając gęstość wody za pomocą piknometru, a następnie wykonując obliczenia matematyczne. Ponieważ cząsteczki każdej substancji różnią się od siebie, tak samo będzie z uzyskaną objętością właściwą.
Jeżeli gęstość wody w szerokim zakresie temperatur wynosi 0,997 kg / m3, jego objętość właściwa wynosi 1003 m3/ kg.
Z powietrza

Powietrze jest jednorodną mieszaniną gazową, składającą się głównie z azotu (78%), następnie tlenu (21%) i wreszcie innych gazów w ziemskiej atmosferze. Jego gęstość jest makroskopową ekspresją całej tej mieszaniny cząsteczek, które nie oddziałują skutecznie i nie rozprzestrzeniają się we wszystkich kierunkach..
Ponieważ przyjmuje się, że substancja jest ciągła, jej rozprzestrzenianie się w pojemniku nie zmienia jej składu. Ponownie, mierząc gęstość w opisanych warunkach temperatury i ciśnienia, można określić, jaką objętość zajmuje 1 g powietrza.
Ponieważ objętość właściwa wynosi 1 / ρ, a jej ρ jest mniejsze od objętości wody, to jej objętość właściwa jest większa.
Wyjaśnienie tego faktu opiera się na oddziaływaniach molekularnych wody i powietrza; ta ostatnia, nawet w przypadku wilgoci, nie skrapla się, chyba że zostanie poddana działaniu bardzo niskich temperatur i wysokiego ciśnienia.
Z pary
Czy w tych samych warunkach gram pary zajmie objętość większą niż gram powietrza? Powietrze jest gęstsze od wody w fazie gazowej, ponieważ jest mieszaniną wyżej wymienionych gazów, w przeciwieństwie do cząsteczek wody..
Ponieważ objętość właściwa jest odwrotnością gęstości, gram pary zajmuje większą objętość (jest mniej gęsty) niż gram powietrza.
Fizyczne właściwości pary jako płynu są istotne w wielu procesach przemysłowych: między innymi wewnątrz wymienników ciepła, w celu zwiększenia wilgotności, czyszczenia maszyn..
Istnieje wiele zmiennych, które należy wziąć pod uwagę podczas obsługi dużych ilości pary w przemyśle, zwłaszcza w zakresie mechaniki płynów..
Azot
Podobnie jak w przypadku pozostałych gazów, jego gęstość zależy w znacznym stopniu od ciśnienia (w przeciwieństwie do ciał stałych i cieczy) oraz temperatury. Zatem wartości jego objętości właściwej różnią się w zależności od tych zmiennych. Stąd potrzeba określenia jego objętości właściwej, aby wyrazić system w kategoriach właściwości intensywnych.
Bez wartości eksperymentalnych, poprzez rozumowanie molekularne, trudno jest porównać gęstość azotu z gęstością innych gazów. Cząsteczka azotu jest liniowa (N≡N), a woda jest kanciasta.
Ponieważ „linia” zajmuje mniejszą objętość niż „Bumerang”, Wówczas można się spodziewać, że azot z definicji gęstości (m / V) jest gęstszy od wody. Używając gęstości 12506 kg / m3, objętość właściwa w warunkach, w których mierzono tę wartość, wynosi 0,7996 m3/ Kg; jest po prostu odwrotnością (1 / ρ).
Idealnego gazu
Idealny gaz to taki, który spełnia równanie:
P = nRT / V
Można zauważyć, że równanie nie uwzględnia żadnej zmiennej, takiej jak struktura molekularna lub objętość; nie bierze też pod uwagę, jak cząsteczki gazu oddziałują ze sobą w przestrzeni zdefiniowanej przez system.
W ograniczonym zakresie temperatur i ciśnień wszystkie gazy „zachowują się” tak samo; z tego powodu do pewnego stopnia można założyć, że są one zgodne z równaniem gazu doskonałego. W ten sposób z tego równania można określić różne właściwości gazów, w tym objętość właściwą.
Aby go rozwiązać, konieczne jest wyrażenie równania za pomocą zmiennych gęstości: masy i objętości. Mole są reprezentowane przez n i są wynikiem podzielenia masy gazu przez jego masę cząsteczkową (m / M).
Biorąc w równaniu zmienną masę m, dzieląc ją przez objętość, można uzyskać gęstość; stąd wystarczy wyczyścić gęstość, a następnie „odwrócić” obie strony równania. W ten sposób ostatecznie określa się konkretną objętość.
Poniższy obraz ilustruje każdy z kroków prowadzących do ostatecznego wyrażenia określonej objętości gazu doskonałego.
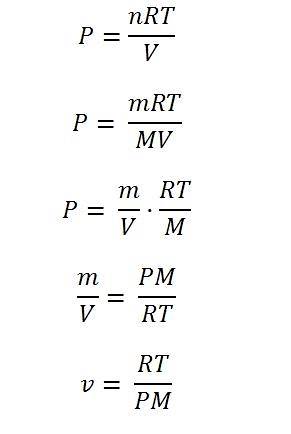
Bibliografia
- Wikipedia. (2018). Określona objętość. Zaczerpnięte z: en.wikipedia.org
- Study.com. (21 sierpnia 2017). Co to jest określona objętość? - Definicja, wzór i jednostki pobrane z: study.com
- GARNEK. (5 maja 2015). Określona objętość. Zaczerpnięte z: grc.nasa.gov
- Michael J. Moran i Howard N. Shapiro. (2004). Podstawy termodynamiki technicznej. (Wydanie 2). Wersja redakcyjna Reverté, strona 13.
- Część 1: Pojęcia termodynamiki. [PDF]. Zaczerpnięte z: 4.tecnun.es
- TLV. (2018). Główne aplikacje dla Steam. Zaczerpnięte z: tlv.com



Jeszcze bez komentarzy