
Struktura, właściwości i zastosowanie tlenku boru (B2O3)
Plik tlenek boru lub bezwodnik borowy jest związkiem nieorganicznym, którego wzór chemiczny to BdwaLUB3. Ponieważ bor i tlen są elementami bloku p układu okresowego, a nawet większą liczbą główek odpowiednich grup, różnica elektroujemności między nimi nie jest zbyt duża; w związku z tym należy się spodziewać, że BdwaLUB3 ma charakter kowalencyjny.
BdwaLUB3 Jest przygotowywany przez rozpuszczenie boraksu w stężonym kwasie siarkowym w piecu do topienia w temperaturze 750 ° C; kwas borowy odwadniający termicznie B (OH)3, w temperaturze około 300 ° C; lub może również powstać jako produkt reakcji diboranu (BdwaH.6) z tlenem.

Tlenek boru może mieć półprzezroczysty szklisty lub krystaliczny wygląd; ten ostatni poprzez rozdrobnienie można uzyskać w postaci proszku (górne zdjęcie).
Chociaż na pierwszy rzut oka może się to nie wydawać, jest uważane za B.dwaLUB3 jako jeden z najbardziej złożonych tlenków nieorganicznych; nie tylko ze strukturalnego punktu widzenia, ale także ze względu na zmienne właściwości, jakie uzyskuje szkło i ceramika, do której jest dodawany do ich matrycy.
Indeks artykułów
- 1 Struktura tlenku boru
- 1.1 Jednostka BO3
- 1.2 Struktura kryształu
- 1.3 Struktura ciała szklistego
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa cząsteczkowa
- 2.3 Smak
- 2.4 Gęstość
- 2.5 Temperatura topnienia
- 2.6 Temperatura wrzenia
- 2.7 Stabilność
- 3 Nazewnictwo
- 4 Zastosowania
- 4.1 Synteza trihalogenków boru
- 4.2 Środek owadobójczy
- 4.3 Rozpuszczalnik tlenków metali: tworzenie się szkieł, ceramiki i stopów boru
- 4.4 Spoiwo
- 5 Referencje
Struktura tlenku boru
Jednostka BO3
BdwaLUB3 jest ciałem kowalencyjnym, więc teoretycznie w jego strukturze nie ma jonów B.3+ ani Odwa-, ale linki B-O. Bor, zgodnie z teorią wiązań walencyjnych (TEV), może tworzyć tylko trzy wiązania kowalencyjne; w tym przypadku trzy obligacje B-O. W konsekwencji oczekiwana geometria musi być trygonalna, BO3.
Cząsteczka BO3 ma niedobór elektronów, zwłaszcza atomów tlenu; jednakże kilka z nich może współdziałać ze sobą, aby uzupełnić wspomniany niedobór. Zatem trójkąty BO3 łączą się, dzieląc most tlenowy i są rozmieszczone w przestrzeni jako sieci trójkątnych rzędów z różnymi płaszczyznami zorientowanymi.
Struktura krystaliczna
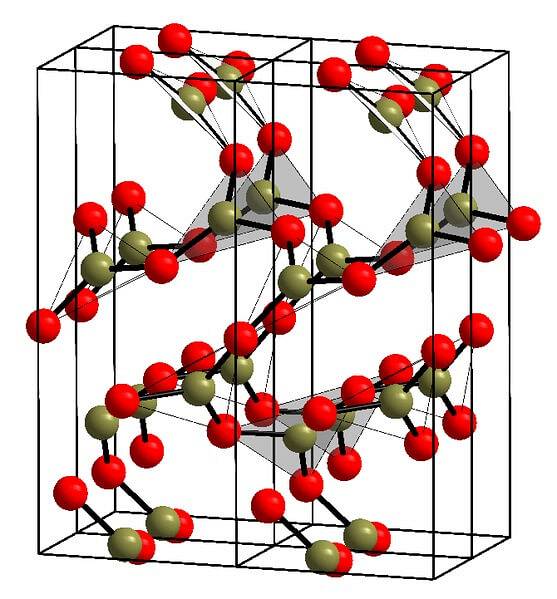
Przykład takich rzędów z trójkątnymi jednostkami BO pokazano na powyższym obrazku.3. Jeśli przyjrzysz się uważnie, nie wszystkie twarze planów wskazują na czytelnika, ale w drugą stronę. Orientacja tych twarzy może być odpowiedzialna za sposób definiowania litery B.dwaLUB3 w określonej temperaturze i ciśnieniu.
Kiedy te sieci mają wzorzec strukturalny dalekiego zasięgu, jest to krystaliczna substancja stała, którą można zbudować z jej komórki elementarnej. W tym miejscu mówi się, że B.dwaLUB3 ma dwa krystaliczne polimorfy: α i β.
Α-BdwaLUB3 jest wytwarzany pod ciśnieniem otoczenia (1 atm) i mówi się, że jest niestabilny kinetycznie; w rzeczywistości jest to jeden z powodów, dla których tlenek boru jest prawdopodobnie związkiem trudnym do krystalizacji.
Drugi polimorf, β-BdwaLUB3, jest otrzymywany przy wysokich ciśnieniach z zakresu GPa; dlatego jego gęstość musi być większa niż gęstość α-BdwaLUB3.
Struktura szklista
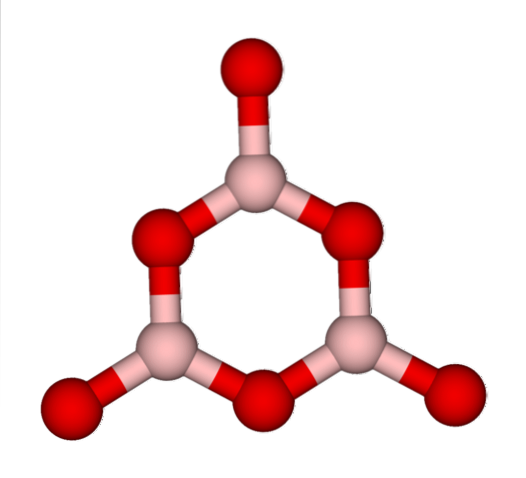
Sieci BO3 naturalnie mają tendencję do przyjmowania struktur amorficznych; To znaczy, że brakuje im wzoru opisującego cząsteczki lub jony w ciele stałym. Podczas syntezy BdwaLUB3 jego dominująca postać jest bezpostaciowa, a nie krystaliczna; słusznie: jest to ciało stałe bardziej szkliste niż krystaliczne.
Mówi się wtedy, że B.dwaLUB3 jest szklisty lub bezpostaciowy, gdy jego sieci BO3 są niechlujni. Nie tylko to, ale także zmieniają sposób, w jaki się spotykają. Zamiast układać się w trygonalną geometrię, łączą się ze sobą, tworząc coś, co naukowcy nazywają pierścieniem boroksolowym (górne zdjęcie).
Zwróć uwagę na oczywistą różnicę między jednostkami trójkątnymi i sześciokątnymi. Trójkąty charakteryzują B.dwaLUB3 krystaliczny i sześciokątny do B.dwaLUB3 szklisty. Innym sposobem określenia tej fazy amorficznej jest szkło borowe lub wzór: g-BdwaLUB3 („g” pochodzi od słowa szklisty w języku angielskim).
Zatem sieci g-BdwaLUB3 składają się z pierścieni boroksolowych, a nie z jednostek BO3. Jednak plik g-BdwaLUB3 może krystalizować do α-BdwaLUB3, co oznaczałoby wzajemne przekształcenie pierścieni w trójkąty, a także określałoby osiągnięty stopień krystalizacji.
Nieruchomości
Wygląd fizyczny
Jest bezbarwną, szklistą substancją stałą. W swojej krystalicznej postaci jest biały.
Masa cząsteczkowa
69,6182 g / mol.
Smak
Lekko gorzki
Gęstość
-Krystaliczny: 2,46 g / ml.
-Ciało szkliste: 1,80 g / ml.
Temperatura topnienia
Nie ma w pełni określonej temperatury topnienia, ponieważ zależy od tego, jak jest krystaliczny lub szklisty. Czysto krystaliczna postać topi się w 450 ° C; jednakże szklista forma topi się w zakresie temperatur od 300 do 700ºC..
Temperatura wrzenia
Ponownie, zgłoszone wartości nie pasują do tej wartości. Podobno ciekły tlenek boru (stopiony z jego kryształów lub szkła) wrze w 1860ºC.
Stabilność
Musi być suchy, ponieważ pochłania wilgoć, aby przekształcić się w kwas borowy B (OH)3.
Nomenklatura
Tlenek boru można nazwać na inne sposoby, na przykład:
-Trójtlenek diboronu (nomenklatura systematyczna).
-Tlenek boru (III) (nomenklatura zapasów).
-Tlenek boru (nomenklatura tradycyjna).
Aplikacje
Niektóre zastosowania tlenku boru to:
Synteza trihalogenków boru
Od B.dwaLUB3 można zsyntetyzować trihalogenki boru, BX3 (X = F, Cl i Br). Związki te to kwasy Lewisa, dzięki którym do pewnych cząsteczek można wprowadzić atomy boru w celu uzyskania innych pochodnych o nowych właściwościach..
Środek owadobójczy
Stała mieszanina z kwasem borowym BdwaLUB3-B (OH)3, reprezentuje formułę używaną jako środek owadobójczy do użytku domowego.
Rozpuszczalnik do tlenków metali: tworzenie szkieł, ceramiki i stopów boru
Ciekły tlenek boru może rozpuszczać tlenki metali. Z tej powstałej mieszaniny po schłodzeniu uzyskuje się ciała stałe złożone z boru i metali..
W zależności od ilości BdwaLUB3 zastosowana technika i rodzaj tlenku metalu, bogata różnorodność szkieł (borokrzemiany), ceramiki (azotki i węgliki boru) i stopów (jeśli są używane tylko metale).
Ogólnie szkło czy ceramika uzyskują większą odporność i wytrzymałość, a także większą trwałość. W przypadku okularów są one ostatecznie używane w soczewkach optycznych i teleskopowych oraz w urządzeniach elektronicznych..
Spoiwo
Do budowy pieców do wytapiania stali stosuje się cegły ogniotrwałe na bazie magnezu. Tlenek boru jest używany jako spoiwo, pomagając w ciasnym utrzymaniu ich razem..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Trójtlenek boru. Odzyskane z: en.wikipedia.org
- PubChem. (2019). Tlenek boru. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Tlenek Borixa. 20 Mule Team Borax. Odzyskane z: borax.com
- A. Mukhanov, O. O. Kurakevich i V. L. Solozhenko. (s.f.). O twardości tlenku boru (III). LPMTMCNRS, Université Paris Nord, Villetaneuse, Francja.
- Hansen T. (2015). bdwaLUB3 (Tlenek boru). Odzyskany z: digitalfire.com


Jeszcze bez komentarzy