
Struktura tlenku cynku (ZnO), właściwości, zastosowania, zagrożenia

Plik tlenek cynku Jest to związek nieorganiczny, którego wzór chemiczny to ZnO. Składa się wyłącznie z jonów Zndwa+ mniedwa- w stosunku 1: 1; jednak w jego sieci krystalicznej może występować wakat Odwa-, co powoduje defekty strukturalne, które mogą zmienić kolory twoich syntetycznych kryształów.
Jest on pozyskiwany w handlu w postaci sproszkowanej białej substancji stałej (dolna ilustracja), która jest wytwarzana bezpośrednio z utleniania metalicznego cynku w procesie francuskim; lub poddawanie rud cynku redukcji karbotermicznej w taki sposób, że ich opary są następnie utleniane i ostatecznie zestalają się.

Inne metody otrzymywania ZnO polegają na strącaniu jego wodorotlenku, Zn (OH)dwa, z wodnych roztworów soli cynku. Podobnie zróżnicowane morfologicznie cienkie warstwy lub nanocząstki ZnO można zsyntetyzować przy użyciu bardziej wyrafinowanych technik, takich jak chemiczne osadzanie jego oparów..
Ten tlenek metalu występuje w naturze jako mineralny cynkit, którego kryształy są zwykle żółte lub pomarańczowe z powodu metalicznych zanieczyszczeń. Kryształy ZnO charakteryzują się tym, że są piezoelektryczne, termochromowe, luminescencyjne, polarne, a także mają bardzo szerokie pasmo energii w swoich właściwościach półprzewodnikowych.
Strukturalnie jest izomorficzny z siarczkiem cynku, ZnS, przyjmując sześciokątne i sześcienne kryształy podobne do kryształów wurzitu i blendy. W nich występuje pewien kowalencyjny charakter w oddziaływaniach między Zndwa+ mniedwa-, co powoduje niejednorodny rozkład ładunków w krysztale ZnO.
Badania właściwości i zastosowań ZnO obejmują dziedziny fizyki, elektroniki i biomedycyny. Jego najprostsze i najbardziej codzienne zastosowania pozostają niezauważone w składzie kremów do twarzy i środków higieny osobistej, a także w kremie przeciwsłonecznym.
Indeks artykułów
- 1 Struktura
- 1.1 Polimorfy
- 1.2 Interakcje
- 1.3 Morfologia nanocząstek
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Temperatura topnienia
- 2.4 Gęstość
- 2.5 Rozpuszczalność w wodzie
- 2.6 Amfoterycyzm
- 2.7 Pojemność cieplna
- 2.8 Bezpośrednia przerwa energetyczna
- 3 Zastosowania
- 3.1 Leczniczy
- 3.2 Antybakteryjne
- 3.3 Pigmenty i powłoki
- 3.4 Bioobrazy
- 3.5 Dodatek
- 3.6 Środek wiążący siarkowodór
- 4 Ryzyka
- 5 Referencje
Struktura
Polimorfy
ZnO krystalizuje w normalnych warunkach ciśnienia i temperatury w sześciokątnej strukturze wurzytu. W tej strukturze jony Zndwa+ mniedwa- ułożone są naprzemiennie w taki sposób, że każda z nich zostaje otoczona czworościanem z ZnO4 lub OZn4, odpowiednio.
Ponadto, stosując „matrycę” lub sześcienne podłoże, ZnO można doprowadzić do krystalizacji do sześciennej struktury mieszanki cynkowej; które, podobnie jak wurzite, odpowiadają strukturom izomorficznym (identycznym w przestrzeni, ale z różnymi jonami) siarczku cynku, ZnS.
Oprócz tych dwóch struktur (wurzite i blende), ZnO pod wysokim ciśnieniem (około 10 GPa) krystalizuje w strukturze soli kamiennej, takiej samej jak struktura NaCl.
Interakcje
Interakcje między Zndwa+ mniedwa- wykazują pewien charakter kowalencyjny, więc występuje częściowo wiązanie kowalencyjne Zn-O (oba atomy z hybrydyzacją sp3), a ze względu na zniekształcenie czworościanów manifestują moment dipolowy, który zwiększa jonowe przyciąganie kryształów ZnO.
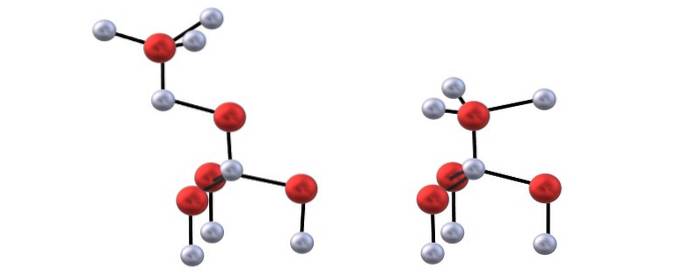
Masz górny obraz, aby zwizualizować czworościany wspomniane dla struktur ZnO.
Różnica między strukturami blendy i wurzite polega również na tym, że widziane z góry jony nie są zaćmione. Na przykład w wurzite ocenia się, że białe kule (Zndwa+) znajdują się tuż nad czerwonymi kulkami (Odwa-). Z drugiej strony w sześciennej strukturze blendy tak się nie dzieje, ponieważ istnieją trzy warstwy: A, B i C zamiast tylko dwóch.
Morfologia nanocząstek
Chociaż kryształy ZnO mają tendencję do posiadania sześciokątnych struktur wurzitu, morfologia ich nanocząstek to inna historia. W zależności od parametrów i metod syntezy mogą one przybierać różne formy, między innymi pręcików, talerzy, liści, kulek, kwiatów, pasów, igieł..
Nieruchomości
Wygląd fizyczny
Białe, bezwonne, pudrowe ciało stałe o gorzkim smaku. W naturze można go znaleźć w postaci skrystalizowanej, z metalicznymi zanieczyszczeniami, takimi jak minerał cynkit. Jeśli takie kryształy są białe, to wykazują termochromizm, co oznacza, że po podgrzaniu zmieniają kolor: z białego na żółty..
Podobnie, jego syntetyczne kryształy mogą mieć czerwonawe lub zielonkawe zabarwienie w zależności od ich stechiometrycznego składu tlenu; to znaczy luki lub luki spowodowane brakiem anionów Odwa- bezpośrednio wpływa na sposób, w jaki światło oddziałuje z sieciami jonowymi.
Masa cząsteczkowa
81,406 g / mol
Temperatura topnienia
1974 ° C W tej temperaturze ulega rozkładowi termicznemu, uwalniając opary cynku i tlen cząsteczkowy lub gazowy..
Gęstość
5,1 g / cm3
Rozpuszczalność w wodzie
ZnO jest praktycznie nierozpuszczalny w wodzie, prawie nie powodując powstania roztworów o stężeniu 0,0004% w 18 ºC.
Amfoterycyzm
ZnO może reagować zarówno z kwasami, jak i zasadami. Kiedy reaguje z kwasem w roztworze wodnym, jego rozpuszczalność wzrasta, tworząc rozpuszczalną sól, w której Zndwa+ kończy się kompleksowaniem z cząsteczkami wody: [Zn (OHdwa)6]dwa+. Na przykład reaguje z kwasem siarkowym, tworząc siarczan cynku:
ZnO + Hdwapołudniowy zachód4 → ZnSO4 + H.dwaLUB
Podobnie reaguje z kwasami tłuszczowymi, tworząc ich odpowiednie sole, takie jak stearynian cynku i palmitynian..
A kiedy reaguje z zasadą, w obecności wody powstają sole cynku:
ZnO + 2NaOH + HdwaO → Nadwa[Zn (OH)4]
Pojemność cieplna
40,3 J / K mol
Bezpośrednia przerwa energetyczna
3,3 eV. Ta wartość sprawia, że jest to półprzewodnik szerokopasmowy, zdolny do pracy w warunkach silnego pola elektrycznego. Ma również cechy bycia półprzewodnikiem tego typu n, który nie był w stanie wyjaśnić powodów, dla których istnieje dodatkowy wkład elektronów w jego strukturę.
Tlenek ten wyróżnia się właściwościami optycznymi, akustycznymi i elektronicznymi, dzięki czemu jest uznawany za kandydata do potencjalnych zastosowań związanych z rozwojem urządzeń optoelektronicznych (sensory, diody laserowe, ogniwa fotowoltaiczne). Przyczyna takich właściwości wykracza poza dziedzinę fizyki.
Aplikacje
Leczniczy
Tlenek cynku był stosowany jako dodatek w wielu białych kremach do leczenia podrażnień, trądzików, zapalenia skóry, otarć i pęknięć skóry. W tym obszarze jego stosowanie jest popularne w łagodzeniu podrażnień skóry niemowląt spowodowanych pieluchami..
Jest również składnikiem filtrów przeciwsłonecznych, ponieważ wraz z nanocząsteczkami dwutlenku tytanu TiOdwa, Pomaga blokować promieniowanie ultrafioletowe słońca, działa również jako środek zagęszczający, dlatego występuje w niektórych lekkich kosmetykach do makijażu, lotionach, emaliach, talach i mydłach..
Z drugiej strony ZnO jest źródłem cynku używanego w suplementach diety i produktach witaminowych, a także w zbożach..
Przeciwbakteryjny
Zgodnie z morfologią jego nanocząstek, ZnO może być aktywowany pod wpływem promieniowania ultrafioletowego w celu wytworzenia nadtlenków wodoru lub reaktywnych form, które osłabiają błony komórkowe mikroorganizmów.
Kiedy tak się dzieje, pozostałe nanocząsteczki ZnO brudzą cytoplazmę i zaczynają oddziaływać z kompendium biocząsteczek tworzących komórkę, powodując ich apoptozę..
Dlatego nie wszystkie nanocząsteczki można stosować w kompozycjach przeciwsłonecznych, ale tylko te, które nie mają działania przeciwbakteryjnego..
Produkty z tego typu ZnO są przeznaczone, pokryte rozpuszczalnymi materiałami polimerowymi, do leczenia infekcji, ran, wrzodów, bakterii, a nawet cukrzycy..
Pigmenty i powłoki
Pigment znany jako biały cynk to ZnO, który jest dodawany do różnych farb i powłok w celu ochrony powierzchni metalowych, na które są nakładane, przed korozją. Na przykład powłoki z dodatkiem ZnO są używane do ochrony galwanizowanego żelaza..
Z drugiej strony powłoki te zostały również zastosowane na szkle okiennym, aby zapobiec przenikaniu ciepła (jeśli jest na zewnątrz) lub przedostawaniu się ciepła (jeśli jest wewnątrz). Chroni również niektóre materiały polimerowe i tekstylne przed zniszczeniem w wyniku działania promieniowania słonecznego i ciepła..
Bioobrazki
Luminescencję nanocząstek ZnO zbadano pod kątem wykorzystania w bioobrazowaniu, badając w ten sposób wewnętrzne struktury komórek za pomocą promieniującego światła niebieskiego, zielonego lub pomarańczowego..
Przyłączeniowy
ZnO znajduje również zastosowanie jako dodatek w gumach, cementach, materiałach do czyszczenia zębów, szkle i ceramice, ze względu na niższą temperaturę topnienia, a zatem zachowuje się jak topnik..
Eliminator siarkowodoru
ZnO usuwa nieprzyjemne gazy H.dwaTak, pomagając w odsiarczeniu niektórych oparów:
ZnO + HdwaS → ZnS + HdwaLUB
Ryzyka
Tlenek cynku jako taki jest związkiem nietoksycznym i nieszkodliwym, więc ostrożne obchodzenie się z jego substancją stałą nie stanowi żadnego ryzyka..
Problem tkwi jednak w jego dymie, bo choć w wysokich temperaturach ulega rozkładowi, opary cynku w końcu zanieczyszczają płuca i wywołują swego rodzaju „metalową gorączkę”. Choroba ta charakteryzuje się objawami kaszlu, gorączki, uczuciem ucisku w klatce piersiowej i ciągłym metalicznym posmakiem w ustach..
Nie jest również rakotwórczy, a kremy, które go zawierają, nie zwiększają wchłaniania cynku przez skórę, więc filtry przeciwsłoneczne na bazie ZnO są uważane za bezpieczne; chyba że występują reakcje alergiczne, w takim przypadku należy przerwać jego stosowanie.
Jeśli chodzi o niektóre nanocząsteczki zaprojektowane do zwalczania bakterii, mogą one mieć negatywne skutki, jeśli nie są prawidłowo transportowane do miejsca działania..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Tlenek cynku. Odzyskane z: en.wikipedia.org
- Hadis Morkoç i Ümit Özgur. (2009). Tlenek cynku: podstawy, materiały i technologia urządzeń. [PDF]. Odzyskany z: application.wiley-vch.de
- Parihar, M. Raja i R. Paulose. (2018). Krótki przegląd właściwości strukturalnych, elektrycznych i elektrochemicznych nanocząstek tlenku cynku. [PDF]. Odzyskany z: ipme.ru
- A. Rodnyi i I. V. Khodyuk. (2011). Właściwości optyczne i luminescencyjne tlenku cynku. Odzyskany z: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin i Husen, A. (2018). Właściwości nanocząstek tlenku cynku i ich działanie na drobnoustroje. Listy badawcze w nanoskali, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- ChemicalSafetyFacts. (2019). Tlenek cynku. Odzyskany z: chemicalafetyfacts.org
- Jinhuan Jiang, Jiang Pi i Jiye Cai. (2018). Postęp w nanocząsteczkach tlenku cynku do zastosowań biomedycznych. Bioinorganic Chemistry and Applications, tom. 2018, numer artykułu 1062562, 18 stron. doi.org/10.1155/2018/1062562


Jeszcze bez komentarzy