
Właściwości, struktura, zastosowanie tlenku chloru (V)
Plik tlenek chloru (V) jest wysoce niestabilnym związkiem nieorganicznym, którego wzór chemiczny to CldwaLUB5. Jest to jeden z wielu tlenków chloru, które charakteryzują się tym, że są cząsteczkami, a nawet rodnikami.
CldwaLUB5 Znalazł życie tylko w papierze i obliczeniach teoretycznych; jednak jego istnienie nie zostało wykluczone i jest prawdopodobne, że niektóre można scharakteryzować (za pomocą zaawansowanych technik spektroskopii). Na podstawie ogólnych koncepcji chemicznych tego tlenku można przewidzieć, że jest to bezwodnik kwasu chlorowego, HClO3.
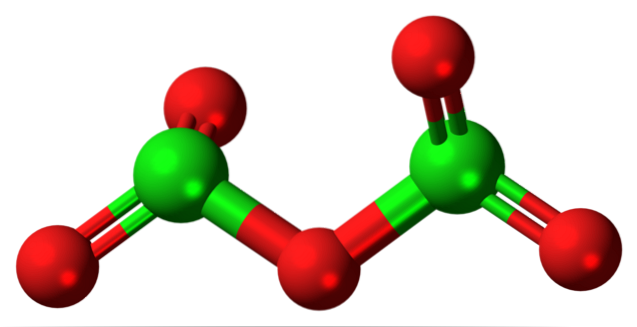
Hipotetyczną cząsteczkę tlenku chloru (V) pokazano powyżej. Zauważ, że ponieważ jest to cząsteczka, obecność jonu Cl w ogóle nie jest brana pod uwagę+5; jeszcze mniej, kiedy musi mieć taką moc polaryzacyjną, aby zmusić tlen do wiązania kowalencyjnego.
Podobnie jak wszystkie niestabilne związki, uwalnia energię, która rozkłada się na bardziej stabilne produkty; proces, który w wielu przypadkach jest wybuchowy. Kiedy CldwaLUB5 rozkłada uwalnia ClOdwa mniedwa. Istnieje teoria, że w wodzie, w zależności od izomeru CldwaLUB5, mogą tworzyć różne oksokwasy chloru.
Indeks artykułów
- 1 Właściwości
- 2 Struktura tlenku chloru (V)
- 2.1 Cząsteczka
- 2.2 Struktura Lewisa
- 2.3 Izomery i ich odpowiednia hydroliza
- 3 Nazewnictwo
- 4 Zastosowania
- 5 Referencje
Nieruchomości
Masa molowa CldwaLUB5 wynosi 150,9030 g / mol. Z tej masy i jej hipotetycznej cząsteczki można przypuszczać, że gdyby można ją było wyodrębnić, byłaby to prawdopodobnie oleista ciecz; oczywiście, porównując to z fizycznym wyglądem CldwaLUB7.
Chociaż nie można go wyodrębnić ani scharakteryzować, ten tlenek chloru jest kwaśny, kowalencyjny i musi mieć również mały moment dipolowy. Jego kwasowość jest zrozumiała, jeśli przeanalizuje się równanie chemiczne jego hydrolizy:
CldwaLUB5 + H.dwaO 2HClO3
Będąc HClO3 kwas chlorowy. Odwrotna reakcja spowodowałaby w przypadku, gdy kwas można odwodnić:
2HClO3 => CldwaLUB5 + H.dwaLUB
Z drugiej strony, gdy CldwaLUB5 mało produkowany, rozkłada się:
2CldwaLUB5 => 4ClOdwa + LUBdwa
Jest to zatem gatunek pośredni, a nie tlenek, właściwie mówiąc. Jego rozkład musi być tak szybki (biorąc pod uwagę, że nawet CldwaLUB5), które nie zostało wykryte przez obecne techniki analizy instrumentalnej.
Struktura tlenku chloru (V)
Cząsteczka
Na górnym obrazku pokazano strukturę hipotetycznej cząsteczki Cl.dwaLUB5 z modelem kul i prętów. Czerwone kule reprezentują atomy tlenu, a zielone kule atomy chloru. Każdy chlor ma środowisko piramidy trygonalnej, więc jego hybrydyzacja musi być sp3.
Tak więc cząsteczka CldwaLUB5 można go postrzegać jako dwie piramidy trygonalne połączone tlenem. Ale jeśli przyjrzysz się uważnie, jedna piramida kieruje swoje atomy tlenu w dół, a druga poza płaszczyznę (w stronę czytelnika)..
Dlatego zakłada się, że w łączu O występują rotacjedwaCl-O-ClOdwa, czyniąc cząsteczkę względnie dynamiczną. Zwróć uwagę, że formuła OdwaCHLOClOdwa jest sposobem przedstawienia struktury CldwaLUB5.
Struktura Lewisa
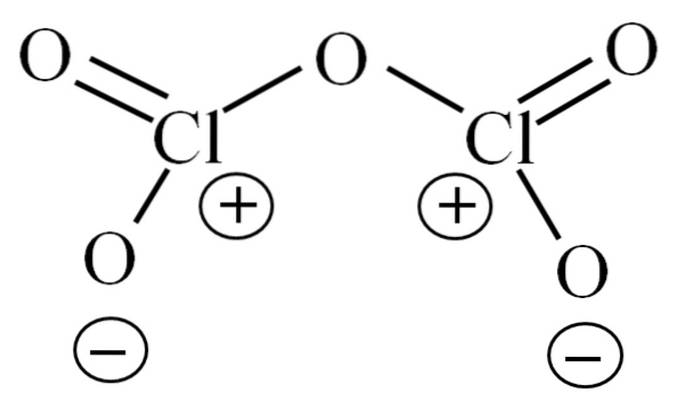
Do tej pory sama cząsteczka nie pozwalała rozszyfrować, z czego wynika jej niestabilność. Aby rzucić światło na to pytanie, zwracamy się do jego struktury Lewisa, przedstawionej powyżej. Zauważ, że konstrukcja może być błędnie uznana za płaską, ale w poprzednim podrozdziale wyjaśniono, że tak nie jest..
Dlaczego oba atomy chloru mają dodatnie ładunki formalne? Ponieważ chlor ma wolną parę elektronów, co można zweryfikować, stosując teorię wiązania Walencji (co nie zostanie tutaj zrobione dla uproszczenia). Zatem jego obciążenie formalne to:
dofa = 7 - (4 + 2) = 1
A co to ma wspólnego z ich niestabilnością? Otóż chlor jest znacznie elektroujemny i dlatego jest słabym nośnikiem dodatnich ładunków formalnych. To wraca do CldwaLUB5 bardzo kwaśny gatunek, ponieważ musi pozyskać elektrony, aby zaspokoić elektroniczne zapotrzebowanie na dwa chlorki.
Odwrotnie dzieje się z BrdwaLUB5 i IdwaLUB5, tlenki, które istnieją w normalnych warunkach. Dzieje się tak, ponieważ zarówno brom, jak i jod są mniej elektroujemne niż chlor; dlatego lepiej wspierają pozytywny ładunek formalny.
Izomery i ich odpowiednia hydroliza
Jak dotąd całe wyjaśnienie dotyczy jednego z dwóch izomerów CldwaLUB5: OdwaCHLOClOdwa. Który jest inny? O3CHLOClO. W tym izomerze chlor nie posiada formalnych ładunków dodatnich i dlatego powinien być bardziej stabilną cząsteczką. Jednak zarówno OdwaCHLOClOdwa jak O3ClOClO powinien ulegać reakcjom hydrolizy:
LUBdwaCl-O-ClOdwa + H.dwaO => 2OdwaCl-OH (które są niczym innym jak HClO3)
LUB3Cl-O-ClO + HdwaO => O3Cl-OH (HClO4) + HO-ClO (HClOdwa)
Należy pamiętać, że może powstać do trzech okso kwasów chloru: HClO3, HClO4 i HClOdwa
Nomenklatura
Jego nazwa „tlenek chloru (V)” odpowiada nazwie nadanej zgodnie z nomenklaturą zapasów. CldwaLUB5 Może mieć również dwie inne nazwy: dichloropentatlenek i bezwodnik chloru, przypisane odpowiednio przez nomenklaturę systematyczną i tradycyjną..
Aplikacje
Więcej niż motywowanie studiów obliczeniowych, CldwaLUB5 Nie będzie używany, dopóki nie zostanie odkryty, wyizolowany, scharakteryzowany, przechowywany i nie zostanie wykazany, że nie eksploduje przy najmniejszym kontakcie..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Sandra Luján Quiroga i Luis José Perissinotti. (2011). Oksokwasy chloru i struktura tlenków chloru. Chem. Educator, tom 16.
- Formulacja chemiczna. (2019). Tlenek chloru (V). Odzyskany z: formulacionquimica.com
- Linus Pauling. (1988). Chemia ogólna. Dover Publications, INC., Nowy Jork.
- Richard C. Ropp. (2013). Encyklopedia związków ziem alkalicznych. Elsevier.


Jeszcze bez komentarzy