
Struktura tlenku żelaza, właściwości, nazewnictwo, zastosowania
ZA tlenek żelaza Jest to dowolny związek powstający między żelazem a tlenem. Charakteryzują się jonizacją i krystalicznością oraz są rozproszone w wyniku erozji ich minerałów, tworzących glebę, masę roślinną, a nawet wnętrze organizmów żywych..
Jest to zatem jedna z rodzin związków dominujących w skorupie ziemskiej. Czym one właściwie są? Do chwili obecnej znanych jest szesnaście tlenków żelaza, z których większość jest pochodzenia naturalnego, a inne są syntetyzowane w ekstremalnych warunkach ciśnienia lub temperatury..

Na powyższym obrazku pokazano część sproszkowanego tlenku żelaza. Jego charakterystyczny czerwony kolor pokrywa żelazo różnych elementów architektonicznych zwane rdzą. Podobnie obserwuje się go na zboczach, górach lub glebach, zmieszanych z wieloma innymi minerałami, takimi jak żółty proszek z getytu (α-FeOOH).
Najbardziej znanymi tlenkami żelaza są hematyt (α-FedwaLUB3) i maghemit (ϒ- FedwaLUB3), oba polimorfy tlenku żelaza; i co nie mniej ważne, magnetyt (Fe3LUB4). Ich polimorficzna struktura i duża powierzchnia sprawiają, że są one interesującymi materiałami jako sorbenty lub do syntezy nanocząstek o szerokich zastosowaniach..
Indeks artykułów
- 1 Struktura
- 1.1 Polimorfizm
- 1.2 Powiązania strukturalne
- 2 Właściwości
- 3 Nazewnictwo
- 3.1 Systematyczne nazewnictwo
- 3.2 Nazewnictwo zapasów
- 3.3 Tradycyjna nomenklatura
- 4 Zastosowania
- 4.1 Nanocząsteczki
- 4.2 Pigmenty
- 5 Referencje
Struktura
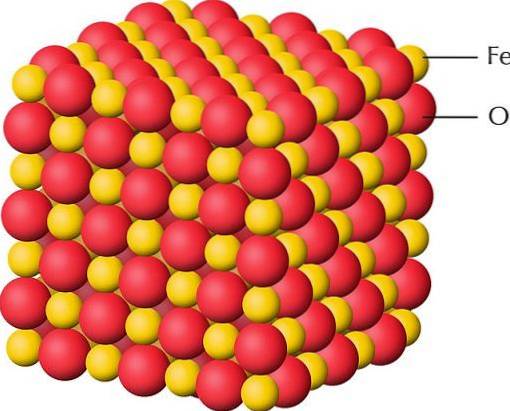
Górny obraz przedstawia strukturę krystaliczną FeO, jednego z tlenków żelaza, w którym żelazo ma wartościowość +2. Czerwone kule odpowiadają anionom Odwa-, podczas gdy żółte do kationów Fedwa+. Zauważ również, że każda wiaradwa+ jest otoczony przez sześć Odwa-, tworząc ośmiościenną jednostkę koordynacji.
Dlatego strukturę FeO można „rozbić” na jednostki FeO.6, gdzie centralnym atomem jest Fedwa+. W przypadku oksywodorotlenków lub wodorotlenków jednostką oktaedryczną jest FeO3(O)3.
W niektórych strukturach zamiast ośmiościanu znajdują się jednostki czworościenne FeO4. Z tego powodu struktury tlenków żelaza są zwykle przedstawiane za pomocą ośmiościanów lub czworościanów z centrami żelaza..
Struktury tlenków żelaza zależą od warunków ciśnienia lub temperatury, od stosunku Fe / O (czyli od tego, ile tlenu przypada na żelazo i odwrotnie) oraz od wartościowości żelaza (+2, +3 i, bardzo rzadko w tlenkach syntetycznych, +4).
Ogólnie rzecz biorąc, nieporęczne aniony Odwa- są wyrównanymi arkuszami formującymi, w których otworach znajdują się kationy Fedwa+ o Wiara3+. Tak więc istnieją tlenki (takie jak magnetyt), które zawierają żelazo o obu wartościowościach.
Wielopostaciowość
Tlenki żelaza wykazują polimorfizm, czyli różne struktury lub układy kryształów tego samego związku. Tlenek żelaza, FedwaLUB3, ma do czterech możliwych polimorfów. Hematyt, α-FedwaLUB3, jest najbardziej stabilny ze wszystkich; po którym następuje maghemita, ϒ- FaithdwaLUB3, i przez syntetyczne β-FedwaLUB3 i ε- FedwaLUB3.
Wszystkie mają swoje własne typy struktur i układów kryształów. Jednak stosunek 2: 3 pozostaje stały, więc mamy trzy aniony O.dwa- na każde dwa kationy Fe3+. Różnica polega na umiejscowieniu ośmiościennych jednostek FeO.6 w kosmosie i jak jesteście razem.
Powiązania strukturalne

Jednostki ośmiościenne FeO6 można obejrzeć na powyższym obrazku. W rogach ośmiościanu znajduje się Odwa-, podczas gdy w jej centrum wiaradwa+ o Wiara3+(w przypadku FedwaLUB3). Sposób, w jaki te ośmiościany są rozmieszczone w przestrzeni, ujawnia strukturę tlenku.
Jednak wpływają również na to, jak są ze sobą powiązani. Na przykład dwa ośmiościany można połączyć, dotykając dwóch ich wierzchołków, co jest reprezentowane przez mostek tlenowy: Fe-O-Fe. Podobnie ośmiościany mogą łączyć się przez swoje krawędzie (sąsiadujące ze sobą). Byłby wówczas przedstawiony za pomocą dwóch mostków tlenowych: Fe- (O)dwa-Wiara.
I wreszcie ośmiościany mogą wchodzić w interakcje poprzez twarze. Zatem reprezentacja byłaby teraz z trzema mostkami tlenowymi: Fe- (O)3-Fe. Sposób, w jaki oktaedry są połączone, zmieniałby odległości międzyjądrowe Fe-Fe, a zatem fizyczne właściwości tlenku.
Nieruchomości
Tlenek żelaza to związek o właściwościach magnetycznych. Mogą one być anty, ferro lub ferrimagnetyczne i zależą od wartościowości Fe i tego, jak kationy oddziałują w ciele stałym..
Ponieważ struktury ciał stałych są bardzo zróżnicowane, tak samo jak ich właściwości fizyczne i chemiczne.
Na przykład polimorfy i hydraty FedwaLUB3 mają różne wartości temperatur topnienia (które wahają się od 1200 do 1600ºC) i gęstości. Jednak łączy je niska rozpuszczalność związana z Fe3+, mają taką samą masę cząsteczkową, są koloru brązowego i słabo rozpuszczają się w roztworach kwasów.
Nomenklatura
IUPAC ustanawia trzy sposoby na nazwanie tlenku żelaza. Wszystkie trzy są bardzo przydatne, chociaż w przypadku złożonych tlenków (takich jak Fe7LUB9) systematyczne rządzenie innymi dzięki swojej prostocie.
Systematyczne nazewnictwo
Liczby tlenu i żelaza są brane pod uwagę, nazywając je greckimi przedrostkami numeracyjnymi mono-, di-, tri- itp. Zgodnie z tą nomenklaturą FedwaLUB3 nazywa się: tritlenek dałżelazo. I za wiarę7LUB9 jego nazwa brzmiałaby: tlenek żelaza niehepta.
Nazewnictwo zapasów
Dotyczy to wartościowości żelaza. Jeśli chodzi o Faithdwa+, tlenek żelaza jest zapisany ..., a jego wartościowość cyframi rzymskimi ujęto w nawiasach. Za wiarędwaLUB3 jego nazwa to: tlenek żelaza (III).
Zwróć uwagę, że Fe3+ można określić za pomocą sum algebraicznych. Jeśli Odwa- Ma dwa ładunki ujemne, a są ich trzy, a sumują się do -6. Aby zneutralizować to -6, +6 jest wymagane, ale są dwa Fe, więc należy je podzielić przez dwa, + 6/2 = +3:
2X (wartościowość metalu) + 3 (-2) = 0
Po prostu rozwiązując X, uzyskuje się wartościowość Fe w tlenku. Ale jeśli X nie jest liczbą całkowitą (jak ma to miejsce w przypadku prawie wszystkich pozostałych tlenków), to istnieje mieszanina Fedwa+ i wiary3+.
Tradycyjna nomenklatura
Przyrostek -ico jest nadawany przedrostkowi ferr-, gdy Fe ma wartościowość +3, a -oso, gdy jego wartościowość wynosi 2+. Zatem FedwaLUB3 nazywa się: tlenek żelaza.
Aplikacje
Nanocząsteczki
Tlenki żelaza mają wspólną wysoką energię krystalizacji, co pozwala na tworzenie bardzo małych kryształów, ale o dużej powierzchni..
Z tego powodu cieszą się dużym zainteresowaniem w dziedzinach nanotechnologii, gdzie projektują i syntetyzują nanocząstki tlenkowe (NP) do określonych celów:
-Jako katalizatory.
-Jako rezerwuar leków lub genów w organizmie
-W projektowaniu powierzchni sensorycznych dla różnych typów biocząsteczek: białek, cukrów, tłuszczów
-Do przechowywania danych magnetycznych
Pigmenty
Ponieważ niektóre tlenki są bardzo stabilne, można je stosować do barwienia tekstyliów lub nadawania jasnych kolorów powierzchniom dowolnego materiału. Z mozaik na podłogach; farby czerwone, żółte i pomarańczowe (nawet zielone); ceramika, tworzywa sztuczne, skóra, a nawet dzieła architektoniczne.
Bibliografia
- Powiernicy Dartmouth College. (18 marca 2004). Stechiometria tlenków żelaza. Zaczerpnięte z: dartmouth.edu
- Ryosuke Sinmyo i in. (8 września 2016). Odkrycie Fe7LUB9: nowy tlenek żelaza o złożonej strukturze jednoskośnej. Odzyskany z: nature.com
- M. Cornell, U. Schwertmann. Tlenki żelaza: struktura, właściwości, reakcje, występowanie i zastosowania. [PDF]. WILEY-VCH. Zaczerpnięte z: epsc511.wustl.edu
- Alice Bu. (2018). Nanocząsteczki tlenku żelaza, właściwości i zastosowania. Zaczerpnięte z: sigmaaldrich.com
- Ali, A., Zafar, H., Zia, M., ul Haq, I., Phull, A. R., Ali, J. S., & Hussain, A. (2016). Synteza, charakterystyka, zastosowania i wyzwania nanocząstek tlenku żelaza. Nanotechnology, Science and Applications, 9, 49–67. http://doi.org/10.2147/NSA.S99986
- Pigmenty Golchha. (2009). Tlenki żelaza: zastosowania. Zaczerpnięte z: golchhapigments.com
- Preparat chemiczny. (2018). Tlenek żelaza (II). Zaczerpnięte z: formulacionquimica.com
- Wikipedia. (2018). Tlenek żelaza (III). Zaczerpnięte z: https://en.wikipedia.org/wiki/Iron(III)_oxide


Jeszcze bez komentarzy