
Pojęcie liczby utleniania, jak to wydobyć i przykłady
Plik stopień utlenienia, Nazywany również stanem utlenienia, jest to taki, który opisuje przyrost lub utratę elektronów w atomie, przy założeniu, że związek, którego jest częścią, ma charakter czysto jonowy. Dlatego mówiąc o stopniu utlenienia zakłada się, że wszystkie atomy występują jako jony oddziałujące elektrostatycznie.
Chociaż rzeczywisty obraz jest bardziej skomplikowany niż obecność jonów wszędzie, stopień utlenienia jest naprawdę przydatny do interpretacji reakcji redukcji tlenków (redoks). Zmiana tych liczb ujawnia, które gatunki zostały utlenione lub utracone elektrony, lub czy elektrony zostały zredukowane lub pozyskane..

Ładunek jonowy jednoatomowego jonu jest zgodny z jego stopniem utlenienia. Na przykład anion tlenkowy Odwa-, jeden z najbardziej rozpowszechnionych, ponieważ występuje w niezliczonych minerałach, ma stopień utlenienia -2. Jest to interpretowane w następujący sposób: ma dwa dodatkowe elektrony w porównaniu z atomem tlenu O w stanie podstawowym.
Liczby utleniania można łatwo obliczyć na podstawie wzoru cząsteczkowego i często są one bardziej przydatne i istotne, jeśli chodzi o związki nieorganiczne z wypełnieniem jonowym. Tymczasem w chemii organicznej nie ma tego samego znaczenia, ponieważ prawie wszystkie jego wiązania są zasadniczo kowalencyjne..
Indeks artykułów
- 1 Jak uzyskać stopień utlenienia?
- 1.1 Obojętność elektroenergetyczna
- 1.2 Walencja
- 1.3 Zasady ogólne
- 1.4 Działania arytmetyczne
- 2 Przykłady
- 2.1 Tlen
- 2.2 Azot
- 2.3 Chlor
- 2.4 Potas
- 2.5 Siarka
- 2.6 Węgiel
- 2.7 Fosfor
- 3 Odnośniki
Jak uzyskać stopień utlenienia?
Electroneutrality
Suma ładunków jonowych w związku musi wynosić zero, aby był on obojętny. Tylko jony mogą mieć ładunki dodatnie lub ujemne.
Dlatego należy przyjąć, że suma stopni utlenienia musi również wynosić zero. Mając to na uwadze i wykonując pewne obliczenia arytmetyczne, możemy wyodrębnić lub określić stopień utlenienia atomu w dowolnym związku.
Valencias
Wartościowości nie są wiarygodne w określaniu stopnia utlenienia atomu, chociaż istnieje kilka wyjątków. Na przykład wszystkie pierwiastki z grupy 1, metale alkaliczne, mają wartościowość 1, a zatem stały stopień utlenienia +1. To samo dzieje się z metalami ziem alkalicznych z grupy 2 o stopniu utlenienia +2.
Należy pamiętać, że dodatnie stopnie utlenienia są zawsze poprzedzone symbolem „+”: +1, +2, +3 itd. I w ten sam sposób negatywy: -1, -2, -3 itd..
Główne zasady
Przy określaniu stopnia utlenienia należy wziąć pod uwagę kilka ogólnych zasad:
-Stopień utlenienia dla tlenu i siarki wynosi -2: Odwa- i S.dwa-
-Czyste pierwiastki mają stopień utlenienia 0: Fe0, P.40, S80
-Atom wodoru, w zależności od tego, z kim jest związany, ma stopień utlenienia +1 (H.+) lub -1 (H.-)
-Halogeny, o ile nie są związane z tlenem lub fluorem, mają stopień utlenienia -1: F-, Cl-, Br- i ja-
-Dla jonu wieloatomowego, takiego jak OH-, suma stopni utlenienia nie powinna być równa zeru, ale ładunek jonu, który dla OH wyniesie -1- (LUBdwa-H.+)-
-Metale w normalnych warunkach mają dodatnie stopnie utlenienia
Działania arytmetyczne
Załóżmy, że mamy związek PbCO3. Jeśli zidentyfikujemy anion węglanowy, CO3dwa-, obliczenie wszystkich stopni utlenienia będzie proste. Zaczynamy od tego samego węglanu, wiedząc, że stopień utlenienia tlenu wynosi -2:
(DOxLUB3dwa-)dwa-
Suma stopni utlenienia musi wynosić -2:
x + 3 (-2) = -2
x -6 = -2
x = +4
Dlatego stopień utlenienia węgla wynosi +4:
(DO4+LUB3dwa-)dwa-
PbCO3 teraz wyglądałoby to tak:
Pbzdo4+LUB3dwa-
Ponownie dodajemy stopnie utlenienia do zera:
z + 4-6 = 0
z = +2
Dlatego ołów ma stopień utlenienia +2, więc zakłada się, że istnieje w postaci kationu ołowiu.dwa+. Właściwie nie było nawet konieczne wykonywanie tego obliczenia, ponieważ wiedząc, że węglan ma ładunek -2, ołów, jego przeciwjon musi koniecznie mieć ładunek +2, aby zaistniała obojętność elektroenergetyczna.
Przykłady
Oto kilka przykładów stopni utlenienia dla różnych pierwiastków w różnych związkach..
Tlen
Wszystkie tlenki metali zawierają tlen jako Odwa-: CaO, FeO, CrdwaLUB3, BeO, AldwaLUB3, PbOdwa, itp. Jednak w anionie nadtlenkowym Odwadwa-, Każdy atom tlenu ma stopień utlenienia równy -1. Podobnie w anionie ponadtlenkowym Odwa-, każdy atom tlenu ma stopień utlenienia -1/2.
Z drugiej strony, gdy tlen wiąże się z fluorem, uzyskuje dodatnie stopnie utlenienia. Na przykład w difluorku tlenu OFdwa, tlen ma dodatni stopień utlenienia. Który? Wiedząc, że fluor wynosi -1, mamy:
LUBxfadwa-1
x + 2 (-1) = 0
x -2 = 0
x = +2
Zatem tlen ma stopień utlenienia +2 (Odwa+) w OFdwa (LUBdwa+fadwa-).
Azot
Główne stopnie utlenienia azotu to -3 (N3-H.3+1), +3 (N.3+fa3-) i +5 (N.dwa5+LUB5dwa-).
Chlor
Jedna z głównych wartości utleniania chloru wynosi -1. Ale wszystko się zmienia, gdy jest połączone z tlenem, azotem lub fluorem, pierwiastkami bardziej elektroujemnymi. W takim przypadku uzyskuje dodatnie stopnie utlenienia, takie jak: +1 (N3-Cl3+, Cl+fa-, Cldwa+LUBdwa-), +2, +3 (ClOdwa-), +4, +5 (ClOdwa+), +6 i +7 (Cldwa7+LUB7dwa-).
Potas
Potas we wszystkich jego związkach ma stopień utlenienia +1 (K.+); chyba że jest to bardzo szczególny stan, w którym stopień utlenienia może osiągnąć -1 (K.-).
Siarka
Przypadek siarki jest podobny do przypadku chloru: ma stopień utlenienia -2, o ile nie łączy się z tlenem, fluorem, azotem lub tym samym chlorem. Na przykład Twoje inne stopnie utlenienia to: -1, +1 (Sdwa+1Cldwa-), +2 (S.dwa+Cldwa-), +3 (S.dwaLUB4dwa-), +4 (S.4+LUBdwadwa-), +5 i +6 (S.6+LUB3dwa-).
Węgiel
Główne stopnie utlenienia węgla to -4 (C.4-H.4+) i +4 (C4+LUBdwadwa-). W tym miejscu zaczynamy dostrzegać niepowodzenie tej koncepcji. Nie w metanie, CH4, i ani w dwutlenku węgla, COdwa, mamy węgiel jako jony C.4- lub C4+, odpowiednio, ale tworząc wiązania kowalencyjne.
Inne stopnie utlenienia węgla, takie jak -3, -2, -1 i 0, można znaleźć we wzorach cząsteczkowych niektórych związków organicznych. Jednak, i znowu, założenie ładunków jonowych na atomie węgla jest mało poprawne.
Mecz
I wreszcie, główne stopnie utlenienia fosforu wynoszą -3 (Ca3dwa+P.dwa3-), +3 (H.3+P.3+LUB3dwa-) i +5 (strdwa5+LUB5dwa-).
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Clark J. (2018). Stany utleniania (liczby utleniania). Źródło: chemguide.co.uk
- Wikipedia. (2020). Stan utlenienia. Odzyskane z: en.wikipedia.org
- Dr Kristy M. Bailey. (s.f.). Przypisywanie numerów utleniania. Odzyskany z: occc.edu


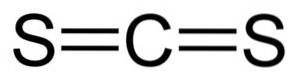
Jeszcze bez komentarzy