
Formuła tlenku litu, właściwości, zagrożenia i zastosowania

Plik tlenek litu Jest to nieorganiczny związek chemiczny o wzorze LidwaLub tworzy się wraz z niewielkimi ilościami nadtlenku litu, gdy lit metaliczny spala się w powietrzu i łączy się z tlenem..
Aż do lat 90-tych rynek metali i litu był zdominowany przez amerykańską produkcję ze złóż mineralnych, ale na początku XXI wieku większość produkcji pochodziła ze źródeł spoza USA; Australia, Chile i Portugalia były najważniejszymi dostawcami na świecie. Boliwia posiada połowę złóż litu na świecie, ale nie jest dużym producentem.
Najważniejszą formą handlową jest węglan litu, LidwaWSPÓŁ3, produkowane z minerałów lub solanek w kilku różnych procesach.
Podczas spalania litu w powietrzu głównym produktem jest biały tlenek litu, LidwaO. Ponadto wytwarzany jest nadtlenek litu, LidwaLUBdwa, również biały.
Można to również zrobić poprzez termiczny rozkład wodorotlenku litu, LiOH lub nadtlenku litu Li2O2.
4Li (s) + Odwa(g) → 2LidwaTy)
2LiOH (s) + ciepło → LidwaO (s) + HdwaO (g)
2LidwaLUBdwa(s) + ciepło → 2LidwaO (s) + Odwa(sol)
Fizyczne i chemiczne właściwości
Tlenek litu to białe ciało stałe zwane litem, które nie ma aromatu i ma słony smak. Jego wygląd pokazano na rysunku 2 (National Center for Biotechnology Information, 2017).

Rysunek 2: wygląd tlenku litu
Tlenek litu to kryształy o geometrii antiflorynu podobnej do chlorku sodu (centrowany sześcienny). Jego strukturę krystaliczną przedstawiono na rysunku 3 (Mark Winter [The University of Sheffield and WebElements Ltd, 2016).
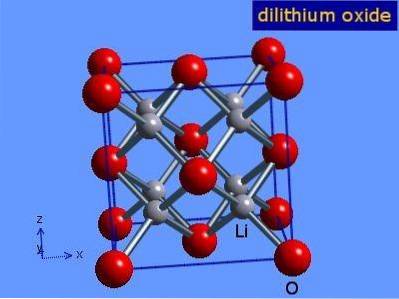
Rysunek 3: struktura krystaliczna tlenku litu.
Jego masa cząsteczkowa wynosi 29,88 g / mol, gęstość 2,013 g / ml, a jego temperatura topnienia i wrzenia wynosi odpowiednio 1438 ° C i 2066 ° C. Związek jest bardzo dobrze rozpuszczalny w wodzie, alkoholu, eterze, pirydynie i nitrobenzenie (Royal Society of Chemistry, 2015).
Tlenek litu łatwo reaguje z parą wodną tworząc wodorotlenek iz dwutlenkiem węgla tworząc węglan; dlatego należy go przechowywać i obchodzić się z nim w czystej i suchej atmosferze..
Związki tlenkowe nie przewodzą prądu. Jednak niektóre strukturyzowane tlenki perowskitu są przewodnikami elektronicznymi, które znajdują zastosowanie w katodzie ogniw paliwowych ze stałym tlenkiem i układach wytwarzania tlenu..
Są to związki zawierające co najmniej jeden anion tlenu i jeden kation metalu (American Elements, S.F.).
Reaktywność i zagrożenia
Tlenek litu jest trwałym związkiem niekompatybilnym z mocnymi kwasami, wodą i dwutlenkiem węgla. Zgodnie z naszą wiedzą chemiczne, fizyczne i toksykologiczne właściwości tlenku litu nie zostały dokładnie zbadane i opisane..
Toksyczność związków litu jest funkcją ich rozpuszczalności w wodzie. Jon litu działa toksycznie na ośrodkowy układ nerwowy. Związek jest silnie żrący i drażniący w przypadku kontaktu z oczami, skórą, wdychania lub spożycia (ESPI METALS, 1993).
W przypadku kontaktu z oczami sprawdź, czy nosisz soczewki kontaktowe i natychmiast je zdejmij. Oczy należy przepłukiwać bieżącą wodą przez co najmniej 15 minut, trzymając powieki otwarte. Można użyć zimnej wody. Nie należy stosować maści do oczu.
Jeśli substancja chemiczna wejdzie w kontakt z ubraniem, zdejmij ją tak szybko, jak to możliwe, chroniąc własne ręce i ciało. Umieść ofiarę pod prysznicem bezpieczeństwa.
Jeśli substancja chemiczna gromadzi się na odsłoniętej skórze ofiary, takiej jak ręce, zanieczyszczoną skórę należy delikatnie i ostrożnie umyć pod bieżącą wodą i nieściernym mydłem. Można użyć zimnej wody. Jeśli podrażnienie utrzymuje się, zasięgnąć porady lekarza. Wyprać zanieczyszczoną odzież przed ponownym użyciem.
W przypadku wdychania poszkodowanego należy pozwolić odpocząć w dobrze wentylowanym miejscu. Jeśli wdychanie jest ciężkie, ofiarę należy jak najszybciej ewakuować w bezpieczne miejsce..
Poluzuj ciasną odzież, taką jak kołnierzyk koszuli, pasek lub krawat. Jeśli ofiara ma trudności z oddychaniem, należy podać tlen. Jeśli ofiara nie oddycha, przeprowadza się resuscytację usta-usta.
Zawsze należy pamiętać, że wykonanie resuscytacji usta-usta może być niebezpieczne dla osoby udzielającej pomocy, gdy wdychany materiał jest toksyczny, zakaźny lub żrący..
We wszystkich przypadkach należy natychmiast zwrócić się o pomoc lekarską (SIGMA-ALDRICH, 2010).
Aplikacje
Tlenek litu jest używany jako topnik w szkliwach ceramicznych i tworzy błękity z miedzią i róże z kobaltem. Tlenek litu reaguje z wodą i parą, tworząc wodorotlenek litu i należy go od nich odizolować.
Tlenek litu (LidwaO) ze swoim wysokim potencjałem trytu jest atrakcyjnym kandydatem na stały materiał kulturowy elektrowni termojądrowej DT, ze względu na dużą gęstość atomów litu (w porównaniu do innych litowych lub litowo-metalicznych materiałów ceramicznych) i stosunkowo wysoką przewodność cieplną (TLENEK LITU) (Li2O), SF).
LidwaLub będzie narażony na wysokie temperatury pod wpływem promieniowania neutronowego podczas operacji topienia koca. W takich okolicznościach w Li wystąpi duża liczba defektów napromieniowaniadwaLub, takich jak pęcznienie wywołane helem, stosunkowo wysoka rozszerzalność cieplna, wzrost ziarna, tworzenie się i wytrącanie LiOH (T) w niskich temperaturach oraz transport masy LiOH (T) w wysokich temperaturach.
Ponadto LidwaLub będzie narażony na naprężenia wynikające z różnic w rozszerzalności cieplnej między LidwaLub i materiały konstrukcyjne. Te cechy LidwaLub prowadzić do trudnych problemów inżynieryjnych zarówno w produkcji, jak i projektowaniu koców.
Jednym z możliwych nowych zastosowań jest zastąpienie tlenku kobaltu litu jako katody w akumulatorach litowo-jonowych używanych do zasilania urządzeń elektronicznych, od telefonów komórkowych po laptopy, a także samochodów zasilanych z baterii (Reade International Corp, 2016)..
Bibliografia
- Mark Winter [The University of Sheffield and WebElements Ltd. (2016). elementy sieciowe. Zaczerpnięte z litu: tlenek dilitu webelements.com.
- Elementy amerykańskie. (S.F.). Tlenek litu. Zaczerpnięte z americanelements americanelements.com.
- METALE ESPI. (1993, czerwiec). Tlenek litu. Zaczerpnięte z espimetals espimetals.com.
- TLENEK LITU (Li2O). (S.F.). Zaczerpnięte z ferp.ucsd.edu ferp.ucsd.edu.
- Narodowe Centrum Informacji Biotechnologicznej. (24 czerwca 2017). Baza danych PubChem Compound; CID = 166630. Zaczerpnięte z PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Proszek Tlenku Litu (Li2O). Zaczerpnięte z reade reade.com
- Królewskie Towarzystwo Chemii. (2015). Tlenek litu.Zaczerpnięte z chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Karta charakterystyki materiału Tlenek litu. Zaczerpnięte z chemblink chemblink.com.


Jeszcze bez komentarzy