
Struktura, właściwości i zastosowanie tlenku złota (III) (Au2O3)
Plik tlenek złota (III) jest związkiem nieorganicznym, którego wzór chemiczny to AudwaLUB3. Teoretycznie można by oczekiwać, że będzie miał charakter kowalencyjny. Jednak nie można całkowicie wykluczyć obecności pewnego charakteru jonowego w jego ciele stałym; lub co jest takie samo, załóżmy, że nie ma kationu3+ obok anionu Odwa-.
Może się wydawać sprzeczne, że złoto, jako metal szlachetny, może rdzewieć. W normalnych warunkach kawałki złota (jak gwiazdy na poniższym obrazku) nie mogą zostać utlenione przez kontakt z tlenem w atmosferze; jednak po napromieniowaniu promieniowaniem ultrafioletowym w obecności ozonu LUB3, panorama jest inna.

Gdyby złote gwiazdy zostały poddane tym warunkom, zmieniłyby kolor na czerwono-brązowy, charakterystyczny dla AudwaLUB3.
Inne metody otrzymywania tego tlenku zakładałyby obróbkę chemiczną wspomnianych gwiazd; na przykład poprzez konwersję masy złota na jego odpowiedni chlorek, AuCl3.
Następnie do AuCl3, a do pozostałych możliwych soli złota dodaje się mocne podłoże zasadowe; i dzięki temu otrzymuje się uwodniony tlenek lub wodorotlenek, Au (OH)3. Ostatecznie ten ostatni związek jest odwadniany termicznie w celu uzyskania AudwaLUB3.
Indeks artykułów
- 1 Struktura tlenku złota (III)
- 1.1 Aspekty elektroniczne
- 1.2 Nawilża
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa cząsteczkowa
- 2.3 Gęstość
- 2.4 Temperatura topnienia
- 2.5 Stabilność
- 2.6 Rozpuszczalność
- 3 Nazewnictwo
- 4 Zastosowania
- 4.1 Barwienie szkła
- 4.2 Synteza aurates i piorunującego złota
- 4.3 Postępowanie z samoorganizującymi się monowarstwami
- 5 Referencje
Struktura tlenku złota (III)
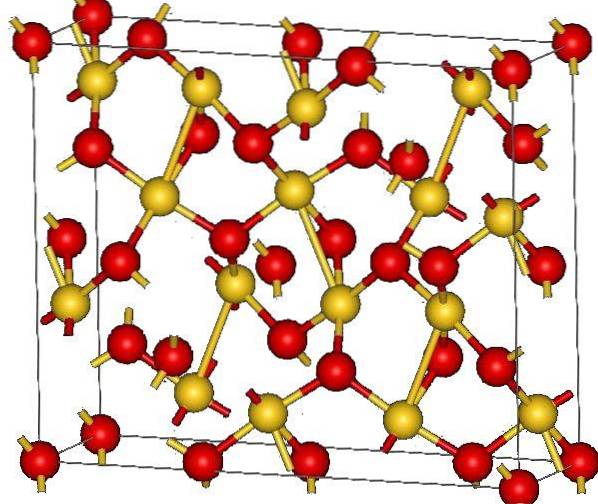
Górny obraz przedstawia strukturę krystaliczną tlenku złota (III). Pokazano rozmieszczenie atomów złota i tlenu w ciele stałym, biorąc pod uwagę atomy obojętne (ciało stałe kowalencyjne) lub jony (ciało stałe jonowe). Obojętnie, w każdym przypadku wystarczy usunąć lub umieścić linki Au-O.
Zgodnie z obrazem zakłada się, że dominuje charakter kowalencyjny (co byłoby logiczne). Z tego powodu atomy i wiązania przedstawione odpowiednio za pomocą kulek i słupków. Złote kule odpowiadają atomom złota (AuIII-O), a czerwonawe na atomy tlenu.
Jeśli przyjrzysz się uważnie, zobaczysz, że są jednostki AuO4, które są połączone atomami tlenu. Innym sposobem wizualizacji byłoby rozważenie, że każde Au3+ jest otoczony przez cztery Odwa-; oczywiście z jonowej perspektywy.
Ta struktura jest krystaliczna, ponieważ atomy są ułożone według tego samego wzoru dalekiego zasięgu. Zatem jego komórka elementarna odpowiada romboedrycznemu układowi krystalicznemu (temu samemu na górnym obrazku). Dlatego wszystkie AudwaLUB3 można by zbudować, gdyby wszystkie te sfery komórki elementarnej były rozmieszczone w przestrzeni.
Aspekty elektroniczne
Złoto jest metalem przejściowym i oczekuje się, że jego orbitale 5d będą oddziaływać bezpośrednio z orbitali 2p atomu tlenu. To nakładanie się ich orbitali powinno teoretycznie generować pasma przewodnictwa, które przekształciłyby AudwaLUB3 w stałym półprzewodniku.
Dlatego prawdziwa struktura AudwaLUB3 mając to na uwadze, jest to jeszcze bardziej złożone.
Nawilża
Tlenek złota może zatrzymywać cząsteczki wody w swoich romboedrycznych kryształach, dając początek hydratom. Kiedy powstają takie hydraty, struktura staje się amorficzna, to znaczy nieuporządkowana.
Wzór chemiczny takich hydratów może być jednym z następujących, które w rzeczywistości nie są w pełni wyjaśnione: AudwaLUB3∙ zHdwaO (z = 1, 2, 3 itd.), Au (OH)3, lub AuxLUBY(O)z.
Wzór Au (OH)3 stanowi nadmierne uproszczenie prawdziwego składu wspomnianych hydratów. Dzieje się tak, ponieważ w wodorotlenku złota (III) naukowcy odkryli również obecność AudwaLUB3; dlatego też nie ma sensu traktowanie go oddzielnie jako „prostego” wodorotlenku metalu przejściowego.
Z drugiej strony z ciała stałego o wzorze AuxLUBY(O)z można było oczekiwać struktury amorficznej; ponieważ zależy to od współczynników x, Y Y z, których zmiany dałyby początek wszelkiego rodzaju strukturom, które z trudem mogłyby wykazywać wzór krystaliczny.
Nieruchomości
Wygląd fizyczny
Jest to czerwono-brązowe ciało stałe.
Masa cząsteczkowa
441,93 g / mol.
Gęstość
11,34 g / ml.
Temperatura topnienia
Topi się i rozkłada w temperaturze 160ºC. Dlatego nie ma temperatury wrzenia, więc ten tlenek nigdy nie osiąga wrzenia..
Stabilność
AUdwaLUB3 jest niestabilny termodynamicznie, ponieważ, jak wspomniano na początku, złoto nie ma tendencji do utleniania się w normalnych warunkach temperaturowych. Dlatego łatwo można go zredukować, by ponownie stać się szlachetnym złotem.
Im wyższa temperatura, tym szybsza reakcja, nazywana rozkładem termicznym. Zatem AudwaLUB3 w 160ºC rozkłada się tworząc metaliczne złoto i uwalniając tlen cząsteczkowy:
2 AudwaLUB3 => 4 Au + 3 Odwa
Bardzo podobna reakcja może wystąpić z innymi związkami, które sprzyjają tej redukcji. Dlaczego redukcja? Ponieważ złoto odzyskuje elektrony, które zabrał mu tlen; co jest tym samym, co powiedzenie, że traci wiązania z tlenem.
Rozpuszczalność
Jest to ciało stałe nierozpuszczalne w wodzie. Jednak jest rozpuszczalny w kwasie solnym i kwasie azotowym ze względu na tworzenie się chlorków złota i azotanów..
Nomenklatura
Tlenek złota (III) to nazwa podlegająca nomenklaturze akcyjnej. Inne sposoby, aby o tym wspomnieć:
-Tradycyjna nomenklatura: tlenek aury, ponieważ wartościowość 3+ jest najwyższa dla złota.
-Nomenklatura systematyczna: trójtlenek dioro.
Aplikacje
Barwienie szkła
Jednym z jego najwybitniejszych zastosowań jest dodanie czerwonawego koloru niektórym materiałom, takim jak szkło, oprócz nadania pewnych właściwości właściwych atomom złota..
Synteza aurates i piorunującego złota
Jeśli dodaje się AudwaLUB3 do ośrodka, w którym jest rozpuszczalny iw obecności metali, po dodaniu mocnej zasady mogą wytrącać się aurany; które są utworzone przez aniony AuO4- w towarzystwie kationów metali.
Również AudwaLUB3 reaguje z amoniakiem, tworząc piorunujący związek złota, AudwaLUB3(NH3)4. Jego nazwa wywodzi się z faktu, że jest wysoce wybuchowy.
Obsługa samoorganizujących się monowarstw
Niektóre związki, takie jak disiarczki dialkilu, RSSR, nie są adsorbowane w ten sam sposób na złocie i jego tlenku. Gdy zachodzi ta adsorpcja, spontanicznie tworzy się wiązanie Au-S, w którym atom siarki wykazuje i określa właściwości chemiczne wspomnianej powierzchni w zależności od grupy funkcyjnej, do której jest przyłączony..
RSSR nie mogą być adsorbowane na AudwaLUB3, ale tak na metalicznym złocie. Dlatego też, jeśli powierzchnia złota jest modyfikowana i jego stopień utlenienia, a także rozmiar cząstek lub warstw AudwaLUB3, można zaprojektować bardziej niejednorodną powierzchnię.
Ta powierzchnia AudwaLUB3-AuSR oddziałuje z tlenkami metali niektórych urządzeń elektronicznych, tworząc w ten sposób inteligentniejsze powierzchnie w przyszłości.
Bibliografia
- Wikipedia. (2018). Tlenek złota (III). Odzyskane z: en.wikipedia.org
- Formulacja chemiczna. (2018). Tlenek złota (III). Odzyskany z: formulacionquimica.com
- D. Michaud. (24 października 2016). Tlenki złota. 911 Metalurg. Odzyskane z: 911metallurgist.com
- Shi, R. Asahi i C. Stampfl. (2007). Właściwości tlenków złota AudwaLUB3 i AudwaAlbo: badanie pierwszych zasad. Amerykańskie Towarzystwo Fizyczne.
- Cook, Kevin M. (2013). Tlenek złota jako warstwa maskująca w regioselektywnej chemii powierzchni. Tezy i rozprawy. Przekaz 1460.



Jeszcze bez komentarzy