
Struktura, właściwości, synteza acetanilidu (C8H9NO)
Plik acetanilid (C8H9NO) to aromatyczny amid, który ma kilka dodatkowych nazw: N-acetyloaryloamina, N-fenyloacetamid i acetanil. Występuje jako bezwonne ciało stałe w postaci płatków, jego chemiczna natura jest amidowa i jako taka może tworzyć łatwopalne gazy w reakcji z silnymi środkami redukującymi..
Ponadto jest słabą zasadą, mogącą reagować ze środkami odwadniającymi, takimi jak P.dwaLUB5 dające początek nitrylowi. Stwierdzono, że acetanilid ma działanie przeciwbólowe i przeciwgorączkowe i został użyty w 1886 r. Pod nazwą Antifebrina przez A. Cahna i P. Heppa..

W 1899 roku wprowadzono na rynek kwas acetylosalicylowy (aspirynę), który miał takie same działanie terapeutyczne jak acetanilid. Ponieważ stosowanie acetanilidu było związane z pojawieniem się sinicy u pacjentów - następstwem methemoglobinemii wywołanej acetanilidem - wykluczono jego stosowanie..
Następnie ustalono, że za przeciwbólowe i przeciwgorączkowe działanie acetanilidu odpowiada jego metabolit zwany paracetamolem (acetoaminofen), który nie wykazuje działania toksycznego, jak sugerują Axelrod i Brodie..
Indeks artykułów
- 1 Struktura chemiczna
- 1.1 Struktury rezonansowe i oddziaływania międzycząsteczkowe
- 2 Właściwości chemiczne
- 2.1 Masa cząsteczkowa
- 2.2 Opis chemiczny
- 2.3 Zapach
- 2.4 Smak
- 2.5 Temperatura wrzenia
- 2.6 Temperatura topnienia
- 2.7 Temperatura zapłonu lub temperatura zapłonu
- 2.8 Gęstość
- 2.9 Gęstość par
- 2.10 Prężność par
- 2.11 Stabilność
- 2.12 Zmienność
- 2.13 Samozapłon
- 2.14 Rozkład
- 2,15 pH
- 2.16 Rozpuszczalność
- 3 Synteza
- 4 Aplikacje
- 5 Referencje
Struktura chemiczna
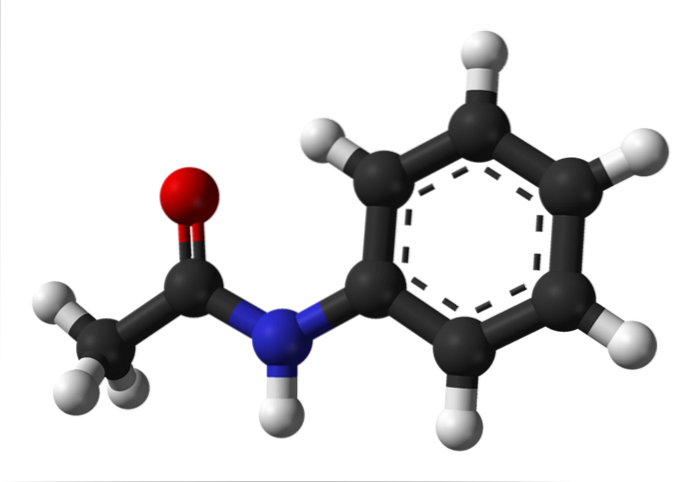
Górny obraz przedstawia strukturę chemiczną acetanilidu. Po prawej stronie znajduje się sześciokątny pierścień aromatyczny benzenu (z przerywanymi liniami), a po lewej powód, dla którego związek składa się z aromatycznego amidu: grupy acetamidowej (HNCOCH3).
Grupa acetamidowa nadaje pierścieniowi benzenowemu bardziej polarny charakter; to znaczy, tworzy moment dipolowy w cząsteczce acetanilidu.
Dlaczego? Ponieważ azot jest bardziej elektroujemny niż którykolwiek z atomów węgla w pierścieniu i jest również związany z grupą acylową, której atom O również przyciąga gęstość elektronów.
Z drugiej strony, prawie cała struktura molekularna acetanilidu spoczywa na tej samej płaszczyźnie z powodu hybrydyzacji spdwa atomów, które go tworzą.
Istnieje wyjątek powiązany z tymi z grupy -CH3, których atomy wodoru tworzą wierzchołki czworościanu (białe kule po lewej stronie wychodzą z płaszczyzny).
Struktury rezonansowe i oddziaływania międzycząsteczkowe
Samotna para bez udziału w atomie N krąży w układzie π pierścienia aromatycznego, tworząc kilka struktur rezonansowych. Jednak jedna z tych struktur kończy się ujemnym ładunkiem na atomie O (bardziej elektroujemnym) i dodatnim ładunkiem na atomie N..
Istnieją zatem struktury rezonansowe, w których ładunek ujemny porusza się w pierścieniu i inne, w których znajduje się w atomie O. W wyniku tej „asymetrii elektronicznej” - która idzie w parze z asymetrią molekularną - acetanilid oddziałuje międzycząsteczkowo przez dipol -siły dipolowe.
Jednak oddziaływania wiązań wodorowych (N-H-O-…) między dwiema cząsteczkami acetanilidu są w rzeczywistości dominującą siłą w ich strukturze krystalicznej..
Zatem kryształy acetanilidu składają się z rombowych komórek elementarnych ośmiu cząsteczek zorientowanych w kształt „płaskiej wstążki” za pomocą wiązań wodorowych..
Można to zwizualizować, umieszczając równolegle jedną cząsteczkę acetanilidu na drugiej. A więc jako grupy HNCOCH3 nakładają się przestrzennie, tworzą wiązania wodorowe.
Ponadto między tymi dwiema cząsteczkami może się „ślizgać” trzecia, ale z pierścieniem aromatycznym skierowanym na przeciwną stronę..
Właściwości chemiczne
Waga molekularna
135,166 g / mol.
Opis chemiczny
Jednolity biały lub białawy. Tworzy błyszczące białe płatki lub biały krystaliczny proszek.
Zapach
Toaleta.
Smak
Lekko ostry.
Temperatura wrzenia
304 ° C do 760 mmHg (579 ° F do 760 mmHg).
Temperatura topnienia
114,3 ° C (237,7 ° F).
Temperatura zapłonu lub temperatura zapłonu
169 ° C (337 ° F). Pomiar wykonany w otwartym szkle.
Gęstość
1219 mg / ml w 15 ° C (1219 mg / ml w 59 ° F)
Gęstość pary
4,65 względem powietrza.
Ciśnienie pary
1 mmHg przy 237ºF, 1,22 × 10-3 mmHg przy 25ºC, 2Pa przy 20ºC.
Stabilność
Pod wpływem światła UV ulega chemicznemu przegrupowaniu. Jak zmienia się struktura? Grupa acetylowa tworzy nowe wiązania na pierścieniu w pozycjach orto i para. Ponadto jest stabilny w powietrzu i niekompatybilny z silnymi utleniaczami, żrącymi i alkaliami..
Zmienność
Odczuwalnie lotny w 95 ºC.
Samozapłon
1004ºF.
Rozkład
Rozkłada się po podgrzaniu, wydzielając silnie toksyczny dym.
pH
5-7 (10 g / L HdwaLub w 25 ºC)
Rozpuszczalność
- W wodzie: 6,93 × 103 mg / ml w 25 ° C.
- Rozpuszczalność 1 g acetanilidu w różnych cieczach: w 3,4 ml alkoholu, 20 ml wrzącej wody, 3 ml metanolu, 4 ml acetonu, 0,6 ml wrzącego alkoholu, 3,7 ml chloroformu, 5 ml gliecerolu, 8 ml dioksanu, 47 ml benzenu i 18 ml eteru. Wodzian chloralu zwiększa rozpuszczalność acetanilidu w wodzie.
Synteza
Jest syntetyzowany w reakcji bezwodnika octowego z acetanilidem. Ta reakcja pojawia się w wielu tekstach Organic Chemistry (Vogel, 1959):
do6H.5NHdwa + (CH3WSPÓŁ)dwaO => C6H.5NHCOCH3 + CH3COOH
Aplikacje
-Jest czynnikiem hamującym proces rozkładu nadtlenku wodoru (nadtlenku wodoru).
-Stabilizuje lakiery na bazie estrów celulozy.
-Interweniuje jako pośrednik w przyspieszaniu produkcji kauczuku. Podobnie jest pośrednikiem w syntezie niektórych barwników i kamfory..
-Działa jako prekursor w syntezie penicyliny.
-Wykorzystywany jest do produkcji chlorku 4-acetamidosulfonylobenzenu. Acetanilid reaguje z kwasem chlorosulfonowym (HSO3Cl), tworząc w ten sposób chlorek 4-aminosulfonylobenzenu. Reaguje z amoniakiem lub pierwszorzędową aminą organiczną, tworząc sulfonamidy..
-Został użyty eksperymentalnie w XIX wieku w rozwoju fotografii.
-Acetanilid jest używany jako marker strumieni elektroosmotycznych (EOF) w elektroforezie kapilarnej do badania powiązań między lekami a białkami..
-Ostatnio (2016) acetanilid został powiązany z 1- (ω-fenoksyalkilouracylem) w eksperymentach w celu zahamowania replikacji wirusa zapalenia wątroby typu C. Acetanilid wiąże się z pozycją 3 pierścienia pirymidynowego.
-Wyniki eksperymentalne wskazują na zmniejszenie replikacji genomu wirusa, niezależnie od genotypu wirusa..
-Zanim stwierdzono toksyczność acetanilidu, był on stosowany od 1886 r. Jako środek przeciwbólowy i przeciwgorączkowy. Później (1891) był stosowany przez Grün w leczeniu przewlekłego i ostrego zapalenia oskrzeli..
Bibliografia
- J. Brown i D. E. C. Corbridge. (1948). Struktura krystaliczna acetanilidu: zastosowanie spolaryzowanego promieniowania podczerwonego. Nature tom 162, strona 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891). Zastosowanie acetanilidu w leczeniu ostrego i przewlekłego zapalenia oskrzeli. Lancet 137 (3539): 1424–1426.
- Magri, A. i in. (2016). Badanie pochodnych acetanilidu 1- (ω-fenoksyalkilo) uracyli jako nowych inhibitorów replikacji wirusa zapalenia wątroby typu C. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilid. Pobrane 5 czerwca 2018 r.Z: sigmaaldrich.com
- Raport wstępnej oceny SIDS dla 13. SIAM. Acetanilid. [PDF]. Pobrane 5 czerwca 2018 r. Z: inchem.org
- Wikipedia. (2018). Acetanilid. Pobrane 5 czerwca 2018 r. Z: en.wikipedia.org
- PubChem. (2018). Acetanilid. Pobrane 5 czerwca 2018 r.Z: pubchem.ncbi.nlm.nih.gov


Jeszcze bez komentarzy