
Struktura, właściwości, synteza i zastosowania octanu izoamylu
Plik octan izoamylu jest estrem, którego wzór cząsteczkowy to CH3COO (CHdwa)dwaCH (CH3)dwa. W temperaturze pokojowej składa się z oleistej, klarownej, bezbarwnej, łatwopalnej i lotnej cieczy. W rzeczywistości jest zbyt lotnym i pachnącym estrem.
Jego główną cechą jest wydzielanie zapachu, który nadaje aromat wielu owocom, zwłaszcza bananom. Podobnie ten ostatni owoc stanowi jedno z jego naturalnych źródeł par excellence..

Stąd nazwa olejku bananowego, którą nadaje się roztworowi octanu izoamylu lub mieszaninie octanu izomylu z nitrocelulozą. Związek jest szeroko stosowany jako przyprawa do żywności, lodów i słodyczy.
Ponadto jest używany do produkcji zapachów o różnym przeznaczeniu. Jest również rozpuszczalnikiem używanym do ekstrakcji metali i związków organicznych, takich jak kwas octowy..
Octan izoamylu jest wynikiem estryfikacji alkoholu izoamylowego kwasem octowym. W laboratoriach dydaktycznych chemii organicznej synteza ta jest interesującym doświadczeniem przy wdrażaniu estryfikacji, zalewając laboratorium zapachem bananów.
Indeks artykułów
- 1 Struktura octanu izoamylu
- 1.1 Oddziaływania międzycząsteczkowe
- 1.2 Zapach bananowy
- 2 Właściwości
- 2.1 Nazwy chemiczne
- 2.2 Wzór cząsteczkowy
- 2.3 Masa cząsteczkowa
- 2.4 Opis fizyczny
- 2.5 Zapach
- 2.6 Smak
- 2.7 Temperatura wrzenia
- 2.8 Temperatura topnienia
- 2.9 Temperatura zapłonu
- 2.10 Rozpuszczalność w wodzie
- 2.11 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.12 Gęstość
- 2.13 Gęstość par
- 2.14 Prężność par
- 2.15 Temperatura samozapłonu
- 2.16 Lepkość
- 2.17 Ciepło spalania
- 2.18 Próg zapachu
- 2.19 Współczynnik załamania światła
- 2.20 Względna szybkość parowania
- 2.21 Stała dielektryczna
- 2.22 Przechowywanie
- 3 Synteza
- 4 Zastosowania
- 4.1 Aromaty do żywności i napojów
- 4.2 Rozpuszczalnik i rozcieńczalnik
- 4.3 Zapachy
- 4.4 Inne
- 5 Ryzyka
- 6 Odnośniki
Struktura octanu izoamylu
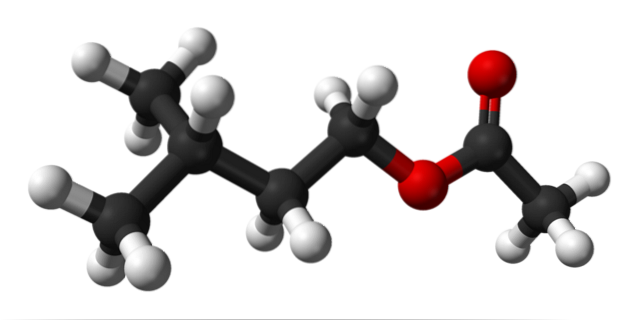
Górny obraz przedstawia strukturę molekularną octanu izoamylu przy użyciu modelu kul i słupków. Czerwone kule odpowiadają atomom tlenu, a konkretnie tym, które identyfikują ten związek jako ester; jego część eterową R-O-R i grupę karbonylową C = O, mającą wówczas wzór strukturalny R'COOR.
Po lewej R', mamy rodnik izopentyloalkilowy (CH3)dwaCHCHdwaCHdwa; a po prawej stronie R do grupy metylowej, której zawdzięcza się „octan” nazwy tego estru. Jest to stosunkowo mały ester, zdolny do interakcji z chemicznymi receptorami zapachu w naszych nosach, wywołując sygnały, które mózg interpretuje jako zapach.
Oddziaływania międzycząsteczkowe
Sama cząsteczka octanu izoamylu jest elastyczna; ale rodnik izopentylowy nie przynosi korzyści interakcjom międzycząsteczkowym, ponieważ jest rozgałęziony, co zapobiega sterycznie skutecznemu oddziaływaniu atomów tlenu poprzez siły dipol-dipol.
Ponadto te dwa tlen nie mogą akceptować wiązań wodorowych; strukturalnie cząsteczka nie ma możliwości ich przekazania. W przeciwieństwie do przerywanych dipoli, octan izoamylu może oddziaływać międzycząsteczkowo za pomocą sił dyspersji London; które są wprost proporcjonalne do ich masy cząsteczkowej.
Zatem to masa cząsteczkowa estru jest odpowiedzialna za tworzenie przez jego cząsteczki cieczy o wysokiej temperaturze wrzenia (141 ° C). Odpowiada również za topienie się ciała stałego w temperaturze -78 ° C.
Zapach bananowy
Jego siły międzycząsteczkowe są tak słabe, że ciecz jest na tyle lotna, że przenika do otoczenia zapachy bananów. Co ciekawe, słodki zapach tego estru może się zmienić, jeśli liczba węgli zostanie zmniejszona lub zwiększona..
To znaczy, gdyby zamiast sześciu alifatycznych atomów węgla miał pięć (z rodnikiem izobutylowym), jego zapach przypominałby zapach malin; gdyby rodnikiem był secbutyl, zapach byłby pełen śladowych ilości rozpuszczalników organicznych; a gdyby miał więcej niż sześć węgli, zapach zacząłby zmieniać się w mydlany i metaliczny zapach.
Nieruchomości
Nazwy chemiczne
-Octan izoamylu
-Etanian izopentylu
-Octan 3-metylobutylu
-Octan izopentylu
-Olej bananowy lub z babki lancetowatej.
Formuła molekularna
do7H.14LUBdwa lub CH3COO (CHdwa)dwaCH (CH3)dwa
Waga molekularna
130,187 g / mol.
Opis fizyczny
Jest oleistą, klarowną i bezbarwną cieczą.
Zapach
W temperaturze pokojowej ma intensywny i przyjemny zapach banana.
Smak
Ma smak zbliżony do gruszki i jabłka.
Temperatura wrzenia
124,5 ° C.
Temperatura topnienia
-78,5 ° C.
punkt zapłonu
Zamknięty tygiel 92ºF (33ºC); otwarty kubek 100ºF (38ºC).
Rozpuszczalność w wodzie
2000 mg / L przy 25 ºC.
Rozpuszczalność w rozpuszczalnikach organicznych
Mieszalny z alkoholem, eterem, octanem etylu i alkoholem amylowym.
Gęstość
0,876 g / cm3.
Gęstość pary
4,49 (względem powietrza = 1).
Ciśnienie pary
5,6 mmHg przy 25 ºC.
Temperatura samozapłonu
680 ºF (360 ºC).
Lepkość
-1,03 cPhum przy 8,97 ° C
-0,872 cPuazy przy 19,91 ° C.
Ciepło spalania
8000 kcal / g.
Próg zapachu
Powietrze = 0,025 µL / L
Woda = 0,017 mg / l.
Współczynnik załamania światła
1400 w 20 ºC.
Względna szybkość parowania
0,42 (względem octanu butylu = 1).
Stała dialektyczna
4,72 w 20 ºC.
Przechowywanie
Octan izoamylu jest związkiem lotnym i łatwopalnym. Dlatego powinien być przechowywany w chłodzie w całkowicie szczelnych pojemnikach, z dala od substancji palnych..
Synteza
Powstaje w wyniku estryfikacji alkoholu izoamylowego lodowatym kwasem octowym w procesie znanym jako estryfikacja Fishera. Kwas siarkowy jest powszechnie stosowany jako katalizator, ale kwas p-toluenosulfonowy również katalizuje reakcję:
(CH3)dwaCH-CHdwa-CHdwaCHdwaOH + CH3COOH => CH3COOCHdwa-CHdwa-CHdwa-CH (CH3)dwa
Aplikacje
Aromaty spożywcze i napoje
Służy do nadania aromatu gruszki w wodzie i syropach. Jest używany w Chinach do przygotowywania smaków owocowych, takich jak truskawka, jeżyna, ananas, gruszka, jabłko, winogrono i banan. Stosowane dawki to: 190 mg / kg w wyrobach cukierniczych; 120 mg / kg w cieście; 56 mg / kg w lodach; i 28 mg / kg w napojach bezalkoholowych.
Rozpuszczalnik i rozcieńczalnik
Jest rozpuszczalnikiem dla:
-Nitroceluloza i celuloid
-Lakiery wodoodporne
-Guma estrowa
-Żywica winylowa
-Żywica kumaronowa i olej rycynowy.
Jest używany jako rozpuszczalnik do oznaczania chromu oraz jako odczynnik ekstrakcyjny żelaza, kobaltu i niklu. Jest również używany jako rozpuszczalnik do farb olejnych i starych lakierów. Ponadto jest używany do produkcji lakierów do paznokci.
Ester ten jest używany jako rozcieńczalnik w produkcji kwasu octowego. Ropa naftowa jest wykorzystywana jako surowiec w procesie utleniania, w wyniku którego powstaje wodny roztwór kwasu octowego i innych związków, takich jak kwas mrówkowy i propionowy..
Jako rozpuszczalnik i nośnik innych substancji był używany we wczesnych dniach przemysłu lotniczego do ochrony tkanin skrzydeł samolotów..
Zapachy
-Służy jako odświeżacz powietrza do zatuszowania nieprzyjemnych zapachów.
-Jest używany jako perfumy w lakierze butów.
-Aby przetestować skuteczność masek gazowych, ponieważ octan izoamylu ma bardzo niski próg zapachu i nie jest bardzo toksyczny.
-Jest używany do produkcji zapachów, takich jak Cypr; miękko pachnący osmantus; hiacynt; i silny orientalny smak, stosowany w małych dawkach, mniej niż 1%.
Inni
Znajduje zastosowanie w produkcji jedwabiu i sztucznych pereł, klisz fotograficznych, wodoodpornych lakierów i bronzerów. Znajduje również zastosowanie w przemyśle tekstylnym do barwienia i wykańczania. Stosowany jest do czyszczenia na sucho artykułów odzieżowych i mebli z tkaniny.
Ponadto octan izoamylu jest używany do produkcji sztucznego jedwabiu, tkaniny syntetycznej; przy ekstrakcji penicyliny oraz jako substancja wzorcowa w chromatografii.
Ryzyka
Octan izoamylu może podrażniać skórę i oczy przy kontakcie fizycznym. Wdychanie może powodować podrażnienie nosa, gardła i płuc. Tymczasem narażenie na wysokie stężenia może powodować bóle głowy, senność, zawroty głowy, zawroty głowy, zmęczenie i omdlenia..
Długotrwały kontakt ze skórą może powodować jej wysuszenie i pękanie..
Bibliografia
- Bilbrey Jenna. (30 lipca 2014). Octan izoamylu. Chemistry World The Royal Society of Chemistry. Źródło: chemistryworld.com
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Octan izoamylu. Baza danych PubChem. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Octan izoamylu. Odzyskane z: en.wikipedia.org
- Królewskie Towarzystwo Chemii. (2015). Octan izoamylu. Chemspider. Źródło: chemspider.com
- Departament Zdrowia i Senior Services stanu New Jersey. (2005). Octan izoamylu. [PDF]. Odzyskany z: nj.gov
- Książka chemiczna. (2017). Octan izoamylu. Odzyskane z: chemicalbook.com



Jeszcze bez komentarzy