
Historia, budowa, właściwości, zastosowanie kwasu octowego
Plik kwas octowy lub kwas etanowy jest bezbarwną cieczą organiczną, której wzór chemiczny to CH3COOH. Po rozpuszczeniu w wodzie uzyskuje się dobrze znaną mieszankę zwaną octem, która od dawna jest stosowana jako dodatek do żywności. Ocet jest wodnym roztworem kwasu octowego o stężeniu około 5%.
Jak nazwa wskazuje, jest związkiem kwaśnym, dlatego ocet ma pH niższe niż 7. W obecności soli octanowej stanowi układ buforowy, który skutecznie reguluje pH w zakresie od 2,76 do 6,76; to znaczy, utrzymuje pH w tym zakresie z umiarkowanymi dodatkami zasady lub kwasu.

Jego wzór wystarczy, aby uświadomić sobie, że powstaje przez połączenie grupy metylowej (CH3) i grupę karboksylową (COOH). Po kwasie mrówkowym HCOOH jest jednym z najprostszych kwasów organicznych; co również stanowi punkt końcowy wielu procesów fermentacyjnych.
Tak więc kwas octowy może być wytwarzany w drodze tlenowej i beztlenowej fermentacji bakteryjnej, a także na drodze syntezy chemicznej, przy czym proces karbonylowania metanolu jest głównym mechanizmem jego wytwarzania..
Oprócz codziennego użytku jako dressing do sałatek, w przemyśle stanowi surowiec do produkcji octanu celulozy, polimeru używanego do produkcji klisz fotograficznych. Dodatkowo kwas octowy wykorzystywany jest w syntezie polioctanu winylu, z którego wytwarza się klej do drewna..
Kiedy ocet stał się silnie stężony, nie jest już tak nazywany i nazywany jest lodowatym kwasem octowym. W tych stężeniach, mimo że jest słabym kwasem, jest silnie żrący i może powodować podrażnienia skóry i dróg oddechowych tylko przez płytkie oddychanie. Lodowaty kwas octowy znajduje zastosowanie jako rozpuszczalnik w syntezach organicznych.
Indeks artykułów
- 1 Historia
- 1,1 1800
- 1,2 1900
- 2 Struktura kwasu octowego
- 3 Właściwości fizyczne i chemiczne
- 3.1 Nazwy chemiczne
- 3.2 Wzór cząsteczkowy
- 3.3 Wygląd fizyczny
- 3.4 Zapach
- 3.5 Smak
- 3.6 Temperatura wrzenia
- 3.7 Temperatura topnienia
- 3.8 Temperatura zapłonu
- 3.9 Rozpuszczalność w wodzie
- 3.10 Rozpuszczalność w rozpuszczalnikach organicznych
- 3.11 Gęstość
- 3.12 Gęstość par
- 3.13 Prężność par
- 3.14 Rozkład
- 3.15 Lepkość
- 3.16 Korozyjność
- 3.17 Ciepło spalania
- 3.18 Ciepło parowania
- 3,19 pH
- 3.20 Napięcie powierzchniowe
- 3,21 pKa
- 3.22 Reakcje chemiczne
- 4 Produkcja
- 4.1 Fermentacja oksydacyjna lub tlenowa
- 4.2 Fermentacja beztlenowa
- 4.3 Karbonylowanie metanolu
- 4.4 Utlenianie aldehydu octowego
- 5 zastosowań
- 5.1 Przemysłowe
- 5.2 Jako rozpuszczalnik
- 5.3 Lekarze
- 5.4 W żywności
- 6 Odnośniki
Fabuła
Człowiek należący do wielu kultur, wykorzystywał fermentację wielu owoców, roślin strączkowych, zbóż itp., Aby uzyskać napoje alkoholowe, produkt przemiany cukrów, takich jak glukoza, w etanol, CH3CHdwaO.
Prawdopodobnie dlatego, że początkową metodą produkcji alkoholu i octu jest fermentacja, być może próbując wyprodukować alkohol w nieokreślonym czasie, wiele wieków temu ocet został uzyskany przez pomyłkę. Zwróć uwagę na podobieństwo między wzorami chemicznymi kwasu octowego i etanolu.
Już w III wieku pne grecki filozof Teofast opisał działanie octu na metale do produkcji pigmentów, takich jak biel ołowiu.
1800
W 1823 roku zaprojektowano w Niemczech urządzenie w kształcie wieży do tlenowej fermentacji różnych produktów w celu uzyskania kwasu octowego w postaci octu..
W 1846 roku Herman Foelbe po raz pierwszy dokonał syntezy kwasu octowego przy użyciu związków nieorganicznych. Synteza rozpoczęła się chlorowaniem dwusiarczku węgla i zakończyła się po dwóch reakcjach redukcją elektrolityczną do kwasu octowego.
Pod koniec XIX i na początku XX wieku dzięki badaniom J. Weizmanna do produkcji kwasu octowego w procesie beztlenowej fermentacji zaczęto wykorzystywać bakterię Clostridium acetobutylicum..
1900
Na początku XX wieku dominującą technologią była produkcja kwasu octowego poprzez utlenianie aldehydu octowego.
W 1925 roku Henry Dreyfus z brytyjskiej firmy Celanese zaprojektował pilotażową instalację do karbonylowania metanolu. Później, w 1963 roku, niemiecka firma BASF wprowadziła kobalt jako katalizator.
Otto Hromatka i Heinrich Ebner (1949) zaprojektowali zbiornik z układem mieszania i dopływem powietrza do fermentacji tlenowej, przeznaczony do produkcji octu. To narzędzie, z pewnymi dostosowaniami, jest nadal w użyciu.
W 1970 roku północnoamerykańska firma Montsanto zastosowała system katalityczny na bazie rodu do karbonylowania metanolu..
Następnie firma BP w 1990 roku wprowadziła proces Cativa z wykorzystaniem katalizatora irydowego w tym samym celu. Ta metoda okazała się bardziej wydajna i mniej agresywna dla środowiska niż metoda Montsanto..
Struktura kwasu octowego
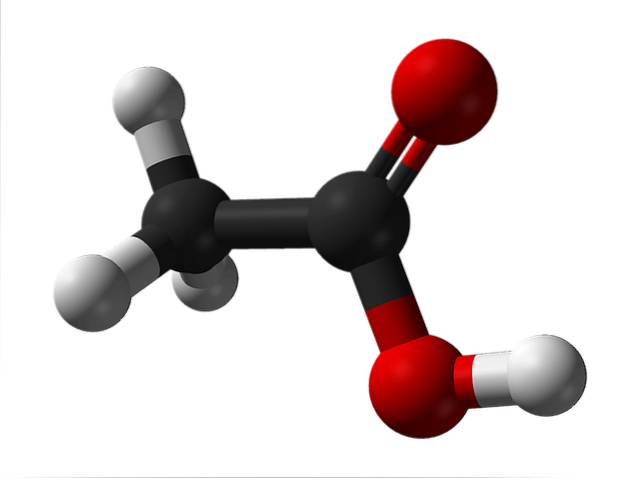
Górny obraz przedstawia strukturę kwasu octowego reprezentowaną przez model kulek i słupków. Czerwone kule odpowiadają atomom tlenu, które z kolei należą do grupy karboksylowej -COOH. Dlatego jest to kwas karboksylowy. Po prawej stronie struktury znajduje się grupa metylowa -CH3.
Jak widać, jest to bardzo mała i prosta cząsteczka. Prezentuje trwały moment dipolowy ze względu na grupę -COOH, która pozwala również kwasowi octowemu na utworzenie dwóch kolejnych wiązań wodorowych.
To właśnie te mosty orientują przestrzennie cząsteczki CH.3COOH do tworzenia dimerów w stanie ciekłym (i gazowym).

Powyżej obrazu można zobaczyć, jak dwie cząsteczki są ustawione, aby utworzyć dwa wiązania wodorowe: O-H-O i O-H-O. Aby odparować kwas octowy, należy dostarczyć wystarczającą ilość energii, aby przerwać te interakcje; powód, dla którego jest to ciecz o temperaturze wrzenia wyższej niż woda (około 118 ° C).
Fizyczne i chemiczne właściwości
Nazwy chemiczne
Kwas:
-Octowy
-Etanoic
-Etyl
Formuła molekularna
dodwaH.4LUBdwa lub CH3COOH.
Wygląd fizyczny
Bezbarwna ciecz.
Zapach
Charakterystyczny akr.
Smak
Palenie.
Temperatura wrzenia
244ºF do 760 mmHg (117,9ºC).
Temperatura topnienia
61,9 ° F (16,6 ° C).
punkt zapłonu
112ºF (otwarty kubek) 104ºF (zamknięty kubek).
Rozpuszczalność w wodzie
106 mg / ml w 25 ºC (miesza się we wszystkich proporcjach).
Rozpuszczalność w rozpuszczalnikach organicznych
Jest rozpuszczalny w etanolu, eterze etylowym, acetonie i benzenie. Jest również rozpuszczalny w czterochlorku węgla.
Gęstość
1,051 g / cm3 przy 68ºF (1,044 g / cm3 przy 25ºC).
Gęstość pary
2,07 (względem powietrza = 1).
Ciśnienie pary
15,7 mmHg w 25 ° C.
Rozkład
Po podgrzaniu powyżej 440 ºC rozkłada się tworząc dwutlenek węgla i metan.
Lepkość
1056 mPaskali w temperaturze 25 ºC.
Korozyjność
Lodowaty kwas octowy jest silnie żrący, a jego spożycie może spowodować poważne uszkodzenia przełyku i odźwiernika u człowieka..
Ciepło spalania
874,2 kJ / mol.
Ciepło parowania
23,70 kJ / mol w 117,9 ° C.
23,36 kJ / mol w 25,0 ° C.
pH
-Roztwór o stężeniu 1 M ma pH 2,4
- Dla roztworu 0,1 M jego pH wynosi 2,9
- I 3,4, jeśli rozwiązaniem jest 0,01 M.
Napięcie powierzchniowe
27,10 mN / m przy 25 ºC.
pKa
4,76 w 25 ° C.
Reakcje chemiczne
Kwas octowy działa korodująco na wiele metali, uwalniając gaz H.dwa i tworząc sole metali zwane octanami. Z wyjątkiem octanu chromu (II) octany są rozpuszczalne w wodzie. Jego reakcję z magnezem przedstawia następujące równanie chemiczne:
Mg (s) + 2 CH3COOH (ag) => (CH3GRUCHAĆ)dwaMg (ag) + Hdwa (sol)
W wyniku redukcji kwas octowy tworzy etanol. Może również tworzyć bezwodnik octowy z utraty wody z dwóch cząsteczek wody..
Produkcja
Jak wspomniano wcześniej, fermentacja wytwarza kwas octowy. Ta fermentacja może być tlenowa (w obecności tlenu) lub beztlenowa (bez tlenu).
Fermentacja oksydacyjna lub tlenowa
Bakterie z rodzaju Acetobacter mogą działać na etanol lub alkohol etylowy, powodując jego utlenianie do kwasu octowego w postaci octu. Tą metodą można wyprodukować ocet o stężeniu 20% kwasu octowego..
Bakterie te są zdolne do produkcji octu, działając na wiele różnych składników, które obejmują różne owoce, sfermentowane rośliny strączkowe, słód, zboża, takie jak ryż lub inne warzywa, które zawierają lub mogą wytwarzać alkohol etylowy..
Reakcja chemiczna wywoływana przez bakterie z rodzaju Acetobacter wygląda następująco:
CH3CHdwaOH + Odwa => CH3COOH + HdwaLUB
Fermentacja oksydacyjna prowadzona jest w zbiornikach z mieszaniem mechanicznym i dopływem tlenu..
Fermentacja beztlenowa
Opiera się na zdolności niektórych bakterii do wytwarzania kwasu octowego poprzez bezpośrednie działanie na cukry, bez konieczności stosowania substancji pośrednich do produkcji kwasu octowego..
do6H.12LUB6 => 3CH3COOH
Bakteria, która bierze udział w tym procesie, to Clostridium acetobutylicum, która oprócz kwasu octowego jest zdolna do ingerowania w syntezę innych związków..
Bakterie acetogenne mogą wytwarzać kwas octowy, działając na cząsteczki złożone tylko z jednego atomu węgla; tak jest w przypadku metanolu i tlenku węgla.
Fermentacja beztlenowa jest tańsza niż fermentacja oksydacyjna, ale jej ograniczenie polega na tym, że bakterie z rodzaju Clostridium nie są bardzo odporne na kwasowość. Ogranicza to jego zdolność do produkcji octu o wysokim stężeniu kwasu octowego, jakie uzyskuje się podczas fermentacji oksydacyjnej..
Karbonylowanie metanolu
Metanol może reagować z tlenkiem węgla, tworząc kwas octowy w obecności katalizatorów
CH3OH + CO => CH3COOH
Wykorzystując jodometan jako katalizator, karbonylowanie metanolu zachodzi w trzech etapach:
W pierwszym etapie kwas jodowodorowy (HI) reaguje z metanolem, wytwarzając jodometan, który w drugim etapie reaguje z tlenkiem węgla, tworząc związek jodoacetaldehyd (CH3COI). Następnie CH3COI nawilża do produkcji kwasu octowego i regeneracji HI.
Proces Monsanto (1966) to metoda wytwarzania kwasu octowego metodą katalitycznej karbonylowania metanolu. Powstaje pod ciśnieniem od 30 do 60 atm, w temperaturze od 150 do 200 ºC, na rodowym układzie katalitycznym..
Proces Monsanto został w dużej mierze zastąpiony przez proces Cativa (1990) opracowany przez BP Chemicals LTD, który wykorzystuje katalizator irydowy. Ten proces jest tańszy i mniej zanieczyszczający.
Utlenianie aldehydu octowego
To utlenianie wymaga metalicznych katalizatorów, takich jak nafteniany, sole manganu, kobalt lub chrom..
2 CH3CHO + Odwa => 2 CH3COOH
Utlenianie aldehydu octowego może mieć bardzo wysoką wydajność, która może osiągnąć 95% przy zastosowaniu odpowiednich katalizatorów. Produkty uboczne reakcji oddziela się od kwasu octowego przez destylację.
Po metodzie karbonylowania metanolu, utlenianie aldehydu octowego jest drugą formą procentową produkcji przemysłowej kwasu octowego.
Aplikacje
Przemysłowy
-Kwas octowy reaguje z etylenem w obecności tlenu, tworząc monomer octanu winylu, stosując pallad jako katalizator reakcji. Octan winylu polimeryzuje do polioctanu winylu, który jest stosowany jako składnik farb i materiałów klejących..
-Reaguje z różnymi alkoholami, tworząc estry, w tym octan etylu i octan propylu. Estry octanowe są stosowane jako rozpuszczalniki do farb drukarskich, nitrocelulozy, powłok, pokostów i lakierów akrylowych..
-Poprzez kondensację dwóch cząsteczek kwasu octowego, utratę jednej cząsteczki cząsteczki, bezwodnik octowy, CH3CO-O-COCH3. Związek ten bierze udział w syntezie octanu celulozy, polimeru stanowiącego tkaninę syntetyczną i wykorzystywanego do produkcji filmów fotograficznych..
Jako rozpuszczalnik
-Jest to polarny rozpuszczalnik posiadający zdolność tworzenia wiązań wodorowych. Jest zdolny do rozpuszczania związków polarnych, takich jak sole nieorganiczne i cukry, ale także rozpuszcza związki niepolarne, takie jak oleje i tłuszcze. Dodatkowo kwas octowy jest mieszalny z rozpuszczalnikami polarnymi i niepolarnymi..
-Mieszalność kwasu octowego w alkanach zależy od wydłużenia ich łańcucha: wraz ze wzrostem długości łańcucha alkanów zmniejsza się jego mieszalność z kwasem octowym.
Lekarze
-Rozcieńczony kwas octowy jest stosowany jako środek antyseptyczny, stosowany miejscowo, mający zdolność zwalczania bakterii, takich jak paciorkowce, gronkowce i Pseudomonas. Dzięki temu działaniu jest stosowany w leczeniu infekcji skóry.
-Kwas octowy jest stosowany w endoskopii przełyku Barretta. Jest to stan, w którym zmienia się wyściółka przełyku, upodabniając ją do wyściółki jelita cienkiego..
-Wydaje się, że 3% żel z kwasem octowym jest skutecznym uzupełnieniem leczenia dopochwowym lekiem Misoprostol, wywołującym aborcję medyczną w środkowym trymestrze, szczególnie u kobiet z pH pochwy 5 lub wyższym..
-Stosowany jako substytut peelingu chemicznego. Jednak przy tym stosowaniu pojawiły się komplikacje, ponieważ odnotowano co najmniej jeden przypadek oparzenia u pacjenta.
W jedzeniu
Ocet od dawna jest stosowany jako przyprawa i przyprawa do żywności, dzięki czemu jest to najbardziej znane zastosowanie kwasu octowego..
Bibliografia
- Byju's. (2018). Co to jest kwas etanowy? Odzyskany z: byjus.com
- PubChem. (2018). Kwas octowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kwas octowy. Odzyskane z: en.wikipedia.org
- Książka chemiczna. (2017). Lodowaty kwas octowy. Odzyskane z: chemicalbook.com
- Kwas octowy: co to jest i do czego służy? Wyzdrowiał z: acidoacetico.info
- Helmenstine, dr Anne Marie (22 czerwca 2018). Co to jest lodowaty kwas octowy? Odzyskany z: thinkco.com



Jeszcze bez komentarzy