
Właściwości bezwodników, sposób ich powstawania i zastosowania
Plik bezwodniki Są to związki chemiczne, które powstają w wyniku połączenia dwóch cząsteczek poprzez uwolnienie wody. Zatem można to postrzegać jako odwodnienie pierwotnych substancji; chociaż nie jest to do końca prawdą.
W chemii organicznej i nieorganicznej wspomina się o nich, aw obu gałęziach ich rozumienie różni się w znacznym stopniu. Na przykład w chemii nieorganicznej tlenki zasadowe i kwasowe są uważane za bezwodniki, odpowiednio, ich wodorotlenków i kwasów, ponieważ te pierwsze reagują z wodą, tworząc te drugie..
W tym przypadku może dojść do pomyłki między terminami „bezwodny” i „bezwodnik”. Ogólnie określenie „bezwodny” odnosi się do związku, do którego został odwodniony bez zmian w jego charakterze chemicznym (nie zachodzi żadna reakcja); podczas gdy w przypadku bezwodnika następuje zmiana chemiczna, odzwierciedlona w strukturze molekularnej.
Jeśli porównamy wodorotlenki i kwasy z odpowiadającymi im tlenkami (lub bezwodnikami), zobaczymy, że nastąpiła reakcja. Z drugiej strony, niektóre tlenki lub sole mogą ulegać hydratacji, tracić wodę i pozostawać tymi samymi związkami; ale bez wody, to znaczy bezwodnego.
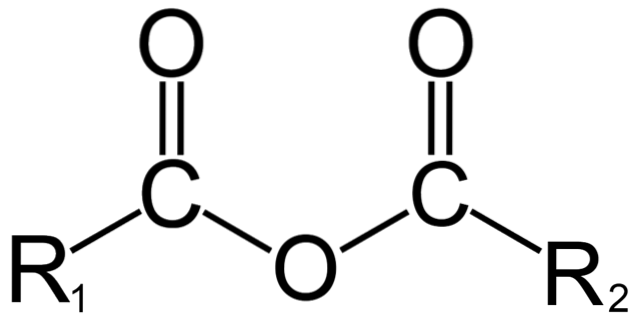
Z drugiej strony, w chemii organicznej bezwodnik jest początkową definicją. Na przykład jednym z najbardziej znanych bezwodników są bezwodniki pochodzące z kwasów karboksylowych (górne zdjęcie). Polegają one na połączeniu dwóch grup acylowych (-RCO) poprzez atom tlenu.
W swojej ogólnej strukturze oznaczono R1 dla grupy acylowej i Rdwa dla drugiej grupy acylowej. Ponieważ R.1 i R.dwa są różne, pochodzą z różnych kwasów karboksylowych i jest to wtedy asymetryczny bezwodnik kwasu. Gdy oba podstawniki R (niezależnie od tego, czy są aromatyczne) są takie same, w takim przypadku mówimy o symetrycznym bezwodniku kwasowym.
Gdy dwa kwasy karboksylowe wiążą się, tworząc bezwodnik, może tworzyć się woda lub nie, jak również inne związki. Wszystko będzie zależało od struktury tych kwasów.
Indeks artykułów
- 1 Właściwości bezwodników
- 1.1 Reakcje chemiczne
- 2 Jak powstają bezwodniki?
- 2.1 Bezwodniki cykliczne
- 3 Nazewnictwo
- 4 Aplikacje
- 4.1 Bezwodniki organiczne
- 5 przykładów
- 5.1 Bezwodnik bursztynowy
- 5.2 Bezwodnik glutarowy
- 6 Odnośniki
Właściwości bezwodników
Właściwości bezwodników będą zależeć od tego, o których mowa. Prawie wszystkie z nich łączy to, że reagują z wodą. Jednak w przypadku tak zwanych zasadowych bezwodników nieorganicznych, w rzeczywistości kilka z nich jest nawet nierozpuszczalnych w wodzie (MgO), więc w tym stwierdzeniu skupimy się na bezwodnikach kwasów karboksylowych.
Temperatura topnienia i wrzenia zależy od struktury molekularnej i oddziaływań międzycząsteczkowych dla (RCO)dwaLub jest to ogólny wzór chemiczny tych związków organicznych.
Jeśli masa cząsteczkowa (RCO)dwaLub jest niski, prawdopodobnie bezbarwna ciecz w temperaturze i ciśnieniu pokojowym. Na przykład bezwodnik octowy (lub bezwodnik etanowy), (CH3WSPÓŁ)dwaLub jest to ciecz o największym znaczeniu przemysłowym, a jej produkcja jest bardzo duża..
Reakcja między bezwodnikiem octowym a wodą jest reprezentowana przez następujące równanie chemiczne:
(CH3WSPÓŁ)dwaO + HdwaO => 2CH3COOH
Zwróć uwagę, że po dodaniu cząsteczki wody uwalniane są dwie cząsteczki kwasu octowego. Odwrotna reakcja nie może jednak wystąpić w przypadku kwasu octowego:
2CH3COOH => (CH3WSPÓŁ)dwaO + HdwaO (nie występuje)
Konieczne jest uciekanie się do innej drogi syntetycznej. Z drugiej strony kwasy dikarboksylowe mogą to robić przez ogrzewanie; ale zostanie to wyjaśnione w następnej sekcji.
Reakcje chemiczne
Hydroliza
Jedną z najprostszych reakcji bezwodników jest ich hydroliza, co zostało właśnie wykazane dla bezwodnika octowego. Oprócz tego przykładu istnieje bezwodnik kwasu siarkowego:
H.dwaSdwaLUB7 + H.dwaLUB <=> 2Hdwapołudniowy zachód4
Tutaj masz bezwodnik kwasu nieorganicznego. Zwróć uwagę, że w przypadku H.dwaSdwaLUB7 (zwany również kwasem disiarkowym), reakcja jest odwracalna, więc ogrzewanie H.dwapołudniowy zachód4 koncentrat powoduje tworzenie się jego bezwodnika. Jeśli z drugiej strony jest to rozcieńczony roztwór H.dwapołudniowy zachód4, SO jest zwolniony3, bezwodnik siarkowy.
Estryfikacja
Bezwodniki kwasowe reagują z alkoholami, z pirydyną pomiędzy, dając ester i kwas karboksylowy. Na przykład rozważmy reakcję między bezwodnikiem octowym i etanolem:
(CH3WSPÓŁ)dwaO + CH3CHdwaOH => CH3WSPÓŁdwaCHdwaCH3 + CH3COOH
W ten sposób tworzy się ester etanianu etylu, CH3WSPÓŁdwaCHdwaCH3, i kwas etanowy (kwas octowy).
W praktyce zachodzi zastąpienie wodoru grupy hydroksylowej grupą acylową:
R1-OH => R1-OCORdwa
W przypadku (CH3WSPÓŁ)dwaLub jego grupą acylową jest -COCH3. Dlatego mówi się, że grupa OH podlega acylowaniu. Jednak acylowanie i estryfikacja nie są pojęciami wymiennymi; acylowanie może zachodzić bezpośrednio na pierścieniu aromatycznym, znanym jako acylacja Friedela-Craftsa.
Zatem alkohole w obecności bezwodników kwasowych są estryfikowane przez acylowanie.
Z drugiej strony tylko jedna z dwóch grup acylowych reaguje z alkoholem, druga pozostaje z wodorem, tworząc kwas karboksylowy; że w przypadku (CH3WSPÓŁ)dwaLub jest kwasem etanowym.
Amidacja
Bezwodniki kwasowe reagują z amoniakiem lub aminami (pierwszorzędowymi i drugorzędowymi), dając początek amidom. Reakcja jest bardzo podobna do właśnie opisanej estryfikacji, ale ROH zastąpiono aminą; na przykład drugorzędową aminę RdwaNH.
Ponownie, reakcja między (CH3WSPÓŁ)dwaO i dietyloamina, EtdwaNH:
(CH3WSPÓŁ)dwaO + 2EtdwaNH => CH3STOŻEKdwa + CH3GRUCHAĆ- +NHdwaEtdwa
I dietyloacetamid, CH3STOŻEKdwa, i karboksylowana sól amonu, CH3GRUCHAĆ- +NHdwaEtdwa.
Chociaż równanie może wydawać się nieco trudne do zrozumienia, spójrz tylko, jak działa grupa -COCH3 zastąpić H w EtdwaNH tworząc amid:
EtdwaNH => EtdwaNCOCH3
Zamiast amidowania reakcja jest nadal acylowaniem. Wszystko jest zawarte w tym słowie; tym razem acylowaniu ulega amina, a nie alkohol.
Jak powstają bezwodniki?
Bezwodniki nieorganiczne powstają w wyniku reakcji pierwiastka z tlenem. Tak więc, jeśli pierwiastek jest metaliczny, tworzy się tlenek metalu lub zasadowy bezwodnik; a jeśli jest niemetaliczny, tworzy się niemetaliczny tlenek lub bezwodnik kwasowy.
W przypadku bezwodników organicznych reakcja jest inna. Dwa kwasy karboksylowe nie mogą łączyć się bezpośrednio w celu uwolnienia wody i utworzenia bezwodnika kwasowego; konieczny jest udział niewymienionego jeszcze związku: chlorku acylu, RCOCl.
Kwas karboksylowy reaguje z chlorkiem acylowym, wytwarzając odpowiedni bezwodnik i chlorowodór:
R1COCl + RdwaCOOH => (R1CO) LUB (CORdwa) + HCl
CH3COCl + CH3COOH => (CH3WSPÓŁ)dwaO + HCl
A CH3 pochodzi z grupy acetylowej CH3CO-, a drugi jest już obecny w kwasie octowym. Wybór konkretnego chlorku acylu, a także kwasu karboksylowego, może prowadzić do syntezy symetrycznego lub asymetrycznego bezwodnika kwasowego.
Bezwodniki cykliczne
W przeciwieństwie do innych kwasów karboksylowych, które wymagają chlorku acylu, kwasy dikarboksylowe mogą kondensować do odpowiadającego im bezwodnika. W tym celu konieczne jest ich podgrzanie, aby promować uwalnianie H.dwaO. Na przykład pokazano tworzenie bezwodnika ftalowego z kwasu ftalowego.

Zwróć uwagę, jak pierścień pięciokątny jest zakończony, a tlen, który łączy obie grupy C = O, jest jego częścią; to jest cykliczny bezwodnik. Podobnie można zauważyć, że bezwodnik ftalowy jest bezwodnikiem symetrycznym, ponieważ zarówno R1 jako R.dwa są identyczne: pierścień aromatyczny.
Nie wszystkie kwasy dikarboksylowe są zdolne do tworzenia bezwodników, ponieważ gdy ich grupy COOH są szeroko rozdzielone, są zmuszone do tworzenia coraz większych pierścieni. Największy pierścień, jaki można utworzyć, to sześciokątny, większy niż to, że reakcja nie zachodzi.
Nomenklatura
Jak nazywa się bezwodniki? Pomijając te nieorganiczne, które dotyczą kwestii tlenkowych, nazwy dotychczas wyjaśnionych bezwodników organicznych zależą od tożsamości R1 i R.dwa; to znaczy jego grup acylowych.
Jeśli dwa R są takie same, po prostu zastąp słowo „kwas” słowem „bezwodnik” w odpowiedniej nazwie kwasu karboksylowego. A jeśli, przeciwnie, dwa R są różne, są nazwane w kolejności alfabetycznej. Dlatego, aby wiedzieć, jak to nazwać, należy najpierw sprawdzić, czy jest to bezwodnik kwasowy symetryczny czy asymetryczny.
CH3WSPÓŁ)dwaO jest symetryczne, ponieważ R1= R.dwa = CH3. Wywodzi się z kwasu octowego lub etanowego, więc jego nazwa, zgodnie z poprzednim wyjaśnieniem, brzmi: bezwodnik octowy lub etanowy. To samo dzieje się ze wspomnianym właśnie bezwodnikiem ftalowym.
Załóżmy, że mamy następujący bezwodnik:
CH3CO (O) COCHdwaCHdwaCHdwaCHdwaCHdwaCH3
Grupa acetylowa po lewej stronie pochodzi z kwasu octowego, a po prawej z kwasu heptanowego. Aby nazwać ten bezwodnik, należy nazwać jego grupy R w porządku alfabetycznym. Tak więc jego nazwa brzmi: heptanowy bezwodnik octowy.
Aplikacje
Bezwodniki nieorganiczne mają nieskończone zastosowania, od syntezy i formułowania materiałów, ceramiki, katalizatorów, cementów, elektrod, nawozów itp., Aż po powłokę skorupy ziemskiej z tysiącami minerałów żelaza i glinu oraz dwutlenkiem węgla wydychanym przez organizmy żywe.
Stanowią one źródło wyjściowe, punkt, z którego pochodzi wiele związków stosowanych w syntezach nieorganicznych. Jednym z najważniejszych bezwodników jest dwutlenek węgla COdwa. Wraz z wodą jest niezbędna do fotosyntezy. A na poziomie przemysłowym SO3 Jest to o tyle istotne, że otrzymuje się z niego pozwany kwas siarkowy.
Być może bezwodnik mający największe zastosowanie i posiadający (dopóki istnieje życie) to jeden z kwasu fosforowego: trójfosforan adenozyny, lepiej znany jako ATP, obecny w DNA i „waluta energetyczna” metabolizmu..
Bezwodniki organiczne
Bezwodniki kwasowe reagują poprzez acylowanie do alkoholu, tworząc ester, aminę, tworząc amid lub pierścień aromatyczny.
Istnieją miliony każdego z tych związków i setki tysięcy opcji kwasu karboksylowego do wytwarzania bezwodnika; w związku z tym możliwości syntetyczne rosną dramatycznie.
Zatem jednym z głównych zastosowań jest włączenie grupy acylowej do związku, podstawienie jednego z atomów lub grup jego struktury..
Każdy oddzielny bezwodnik ma swoje własne zastosowania, ale ogólnie wszystkie reagują w podobny sposób. Z tego powodu tego typu związki są wykorzystywane do modyfikowania struktur polimerowych, tworząc nowe polimery; tj. kopolimery, żywice, powłoki itp..
Na przykład bezwodnik octowy służy do acetylowania wszystkich grup OH w celulozie (dolny obraz). W ten sposób każdy H z OH jest zastępowany przez grupę acetylową, COCH3.
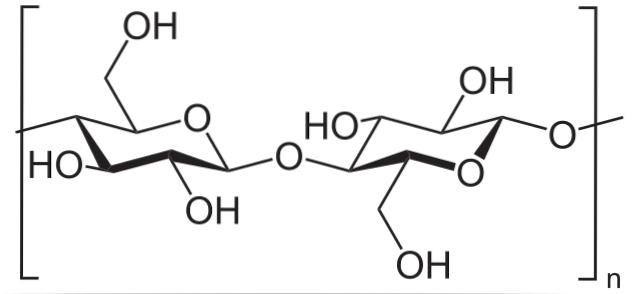
W ten sposób otrzymuje się polimer octanu celulozy. Tę samą reakcję można zarysować dla innych struktur polimerowych z grupami NHdwa, również podatny na acylowanie.
Te reakcje acylowania są również przydatne do syntezy leków, takich jak aspiryna (kwas acetylsalicylowy).
Przykłady
Pokazano inne przykłady bezwodników organicznych. Chociaż nie będzie o nich wzmianki, atomy tlenu można zastąpić siarką, dając siarkę lub nawet bezwodniki fosforu..
-do6H.5CO (O) COC6H.5: bezwodnik benzoesowy. Grupa C6H.5 przedstawia pierścień benzenowy. Jego hydroliza wytwarza dwa kwasy benzoesowe.
-HCO (O) COH: bezwodnik mrówkowy. Jego hydroliza wytwarza dwa kwasy mrówkowe.
- do6H.5CO (O) COCHdwaCH3: bezwodnik benzoesowy propionowy. W wyniku jej hydrolizy powstają kwasy benzoesowy i propanowy.
-do6H.jedenaścieCO (O) COC6H.jedenaście: bezwodnik cykloheksanokarboksylowy. W przeciwieństwie do pierścieni aromatycznych są one nasycone, bez podwójnych wiązań.
-CH3CHdwaCHdwaCO (O) COCHdwaCH3: bezwodnik propionowy butanowy.
Bezwodnik bursztynowy

Tutaj masz inny cykliczny, pochodzący z kwasu bursztynowego, kwas dikarboksylowy. Zwróć uwagę, jak trzy atomy tlenu ujawniają chemiczną naturę tego typu związku.
Bezwodnik maleinowy jest bardzo podobny do bezwodnika bursztynowego, z tą różnicą, że między atomami węgla tworzącymi podstawę pięciokąta występuje podwójne wiązanie..
Bezwodnik glutarowy
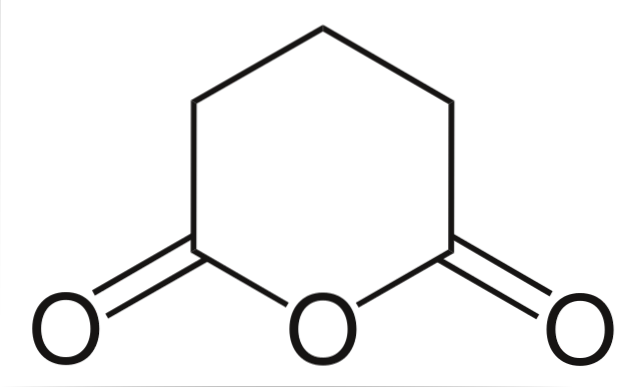
I na koniec pokazano bezwodnik kwasu glutarowego. To strukturalnie wyróżnia się spośród wszystkich innych, składając się z sześciokątnego pierścienia. Ponownie w strukturze wyróżniają się trzy atomy tlenu.
O innych bezwodnikach, bardziej złożonych, zawsze może świadczyć obecność trzech atomów tlenu znajdujących się bardzo blisko siebie.
Bibliografia
- Redaktorzy Encyclopaedia Britannica. (2019). Bezwodnik. Enclyclopaedia Britannica. Odzyskany z: britannica.com
- Helmenstine, dr Anne Marie (08 stycznia 2019). Definicja bezwodnika kwasowego w chemii. Odzyskany z: thinkco.com
- Chemia LibreTexts. (s.f.). Bezwodniki. Źródło: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Bezwodnik kwasu organicznego. Odzyskane z: en.wikipedia.org



Jeszcze bez komentarzy