
Tworzenie, charakterystyka i typy anionów
ZA anion Jest to dowolna substancja chemiczna z ładunkiem ujemnym, oprócz tego, że jest jednym z dwóch rodzajów istniejących jonów. Jego ładunek ujemny wynika z faktu, że ma nadmiar elektronów w porównaniu z obojętną formą gatunku; dla każdego dodatkowego elektronu jego ujemny ładunek wzrasta o jedną jednostkę.
Ładunek ujemny może znajdować się w jednym lub większej liczbie atomów, a także obejmować jego wpływ na cząsteczkę jako całość. Dla uproszczenia, niezależnie od tego, gdzie ładunek jest (-), cały gatunek, związek lub cząsteczka jest uważany za anion..
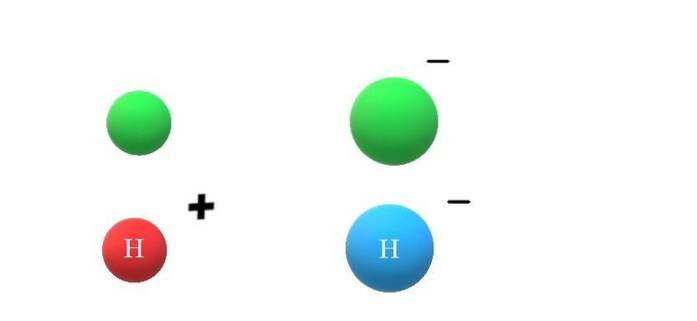
Jeśli obojętny gatunek X zyska elektron, nadmiar ładunków ujemnych przejawi się w tworzeniu anionu X.-, co również doprowadzi do zwiększenia jego promienia atomowego (górny obraz z zielonymi kulkami). X i X- różnią się ogromnie pod względem właściwości i sposobu, w jaki wchodzą w interakcję z otoczeniem.
Jeśli teraz przyjmie się, że X jest atomem H, na przykład, może powstać z niego kation lub anion: H.+ lub H.-, odpowiednio. Kation H.+ Jest to jon wodorowy, zwany także protonem; i H.- jest anionem wodorkowym, „najprostszym” ze wszystkich znanych anionów.
Indeks artykułów
- 1 Tworzenie anionu
- 1.1 Formalne opłaty i mniej linków
- 1.2 Obniżki
- 1.3 Fizyka
- 2 Funkcje
- 3 rodzaje
- 3.1 Jednoatomowe
- 3.2 Oxoanions
- 3.3 Organiczne
- 3.4 Poliatomiczne
- 3.5 Molekularne lub złożone
- 4 Odnośniki
Tworzenie anionu
Tworzenie anionów można łatwo wyjaśnić w teorii; Chociaż, eksperymentalnie, może to być wyzwanie, zwłaszcza jeśli chcesz, aby był czysty, bez ładunków dodatnich przyciąganych przez ładunki ujemne..
Formalne opłaty i mniej linków
Anion utworzy się, gdy w atomie występuje nadmiar lub przyrost elektronów. Wspomniany zysk można określić, wykorzystując ładunki formalne w strukturze Lewisa. Ponadto, używając poprzedniej metody, możesz dokładnie wiedzieć, z którego atomu lub ich grupy pochodzi ładunek ujemny.
Kiedy atomy tworzą wiązania kowalencyjne, nawet jeśli rozkład elektronów jest sprawiedliwy, może nastąpić częściowa utrata elektronów. W tym sensie im mniej wiązań, tym więcej atomów elektroujemnych utworzy się, tym więcej wolnych par elektronów będą miały i tym samym będą wykazywać ładunki ujemne..
Rozważmy na przykład cząsteczkę amoniaku, NH3. NH3 jest neutralny i dlatego nie ma ładunków elektrycznych. Gdyby usunięto H, to znaczy przerwano wiązanie N-H, otrzymano by anion NHdwa-. Rysując jego strukturę Lewisa i obliczając formalny ładunek N, można to zweryfikować.
Po zerwaniu większej liczby wiązań N-H mamy teraz anion NHdwa-; i eliminując ostatni H, ostatecznie otrzymuje się anion N3-, zwany anionem azotkowym. Azot nie ma już sposobu na zdobycie większej liczby elektronów, a jego ładunek -3 jest najbardziej ujemny, jaki może osiągnąć; ich orbitale nie dają na więcej.
Redukcje
W wyniku redukcji może powstać anion: pozyskuje on elektrony poprzez utlenianie innego gatunku, który je traci. Na przykład tlen bardzo dobrze reprezentuje ten typ reakcji chemicznej..
Kiedy tlen jest zredukowany, utlenia się do innego rodzaju i staje się anionem tlenkowym Odwa-; obecny w niezliczonych minerałach i związkach nieorganicznych.
Fizyczny
Atom może zyskać elektrony, jeśli znajduje się w fazie gazowej:
X (g) + e- => X-(sol)
Ten sposób tworzenia anionu wymaga szerokiej wiedzy na temat technik fizycznych, podczas gdy aniony gazowe nie są łatwe do zbadania, a także nie wszystkie gatunki łatwo ulatniają się lub rozpylają do fazy gazowej..
Charakterystyka
Ogólnie rzecz biorąc, przed omówieniem ich typów i przykładów zostaną wymienione poniżej typowe właściwości anionów:
-Jest bardziej masywny niż neutralny atom, z którego się wywodzi.
-Może być mniej lub bardziej stabilny, pomimo rosnącego odpychania elektronicznego między własnymi elektronami.
-Jeśli anion pochodzi z atomu o niskiej elektroujemności, takiego jak węgiel, jest bardzo reaktywny.
-Ustanów silne momenty dipolowe.
-Dalszy wzrost jego interakcji z rozpuszczalnikami polarnymi.
-Anion jednoatomowy jest izoelektroniczny w stosunku do gazu szlachetnego z jego okresu; to znaczy ma taką samą liczbę elektronów w swojej powłoce walencyjnej.
-Może polaryzować chmurę elektronów sąsiedniego atomu, odpychając jego zewnętrzne elektrony.
Rodzaje
Jednoatomowe
Jak sama nazwa wskazuje, jest to anion składający się z pojedynczego atomu: ładunek ujemny jest dobrze umiejscowiony. Każda grupa w układzie okresowym ma charakterystyczne ładunki ujemne; a ponieważ są anionami, są to niemetale znajdujące się w bloku p. Poniżej znajduje się kilka przykładów i ich nazwy:
-Cl-, chlorek.
-ja-, ja ostatni.
-fa-, fluorek.
-Br-, bromek.
-LUBdwa-, tlenek.
-Sdwa-, siarczek.
-wiemdwa-, selenid.
-Herbatadwa-, tellurku.
-Podwa-, poloniur.
-N3-, azotek.
-P.3-, fosforek.
-As3-, arsenek.
-Sb3-, antimoniuro.
-do4-, węglik.
-tak4-, krzemek.
-b3-, boruro.
Oxoanions
Oksoaniony charakteryzują się wiązaniem X = O, gdzie X może oznaczać dowolny pierwiastek niemetaliczny (z wyjątkiem fluoru) lub metal (chrom, mangan itp.). Mogą również mieć jedno lub więcej prostych łączy X-O.
Niektóre oksoaniony z ich nazwami to:
-ClO-, podchloryn.
-Brachu-, hypobromite.
-IO-, podjodyt.
-ClOdwa-, chloryt.
-ClO3-, chloran.
-IO3-, jodan.
-ClO4-, nadchloran.
-PO43-, fosforan.
-WSPÓŁ3dwa-, węglan.
-CrO4dwa-, chromian.
-CrdwaLUB7dwa-, dichromian.
-południowy zachód4dwa-, siarczan.
-SdwaLUB3dwa-, tiosiarczan.
-NIE3-, azotan.
-NIEdwa-, azotyn.
-BO33-, boran.
-AsO43-, arsenian.
-PO33-, fosforyn.
-MnO4-, nadmanganian.
Organiczny
Cząsteczki organiczne mają grupy funkcyjne, które mogą zostać naładowane elektrycznie. W jaki sposób? Poprzez tworzenie lub zrywanie wiązań kowalencyjnych, bardzo podobne do przykładu cząsteczki NH3.
Niektóre aniony organiczne to:
-CH3GRUCHAĆ-, octan.
-HCOO-, Format.
-dodwaLUB4dwa-, szczawian.
-RCOO-, karboksylan.
-CH3CONH-, pośród.
-RO-, alkoholan.
-R3do-, karbanion.
-CH3LUB-, metanolan.
Wieloatomowe
Oksoaniony są również anionami wieloatomowymi, to znaczy składają się z więcej niż jednego atomu. To samo dzieje się z anionami organicznymi. Jednak poliatomiki nie mieszczą się w żadnej z powyższych klasyfikacji. Niektórzy z nich są:
-CN-, cyjanek (ma potrójne wiązanie, C≡N).
-OCN-, cyjanian.
-SCN-, tiocyjanian.
-NHdwa-, Amid.
-O-, hydroksyl, wodorotlenek lub hydroksyl.
-LUBdwa-, ponadtlenek.
-LUBdwadwa-, nadtlenek.
Molekularne lub złożone
W anionach organicznych wymieniono kilka ujemnie naładowanych grup funkcyjnych. Grupy te mogą być częścią dużej cząsteczki, a zatem anion może być całym solidnym związkiem z wieloma wiązaniami. Najprostszym tego typu anionem jest hipotetyczna cząsteczka H.dwa-.
Innym przykładem takich anionów są polisiarczki Sndwa-, które składają się z łańcuchów z wieloma wiązaniami S-S. Również ujemnie naładowane związki koordynacyjne metali, takie jak [CoCl4(NH3)dwa]- i [CuCl4]dwa-.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2019). Anion. Odzyskane z: es.wikipedia.org
- Helmenstine, dr Anne Marie (21 marca 2019). Tabela wspólnych anionów i lista formuł. Odzyskany z: thinkco.com
- Fundacja CK-12. (29 czerwca 2016). Tworzenie anionów. Chemia LibreTexts. Źródło: chem.libretexts.org
- Francis E. (2002). Aniony. Clackamas Community College. Odzyskany z: dl.clackamas.edu
- Amerykańskie Towarzystwo Fizyczne. (3 listopada 2011). Streszczenie: najprostszy anion molekularny. Odzyskane z: physics.aps.org



Jeszcze bez komentarzy