
Historia, struktura, właściwości, zastosowania i zagrożenia antymonu
Plik antymon Jest to błyszczący, srebrny metaloid z pewnym niebieskawym odcieniem. Jego bryła charakteryzuje się również bardzo kruchą i łuszczącą się teksturą. Należy do grupy 15 układu okresowego, na czele której stoi azot. Po bizmucie (i moskovium) jest najcięższym pierwiastkiem z grupy.
Jest reprezentowany przez symbol chemiczny Sb. W naturze występuje głównie w rudach minerałów stibit i ullmannit, których wzór chemiczny to SbdwaS3 i NiSbS, odpowiednio. Jego duża skłonność do tworzenia siarczków zamiast tlenków wynika z jego chemicznej miękkości.

Z drugiej strony antymon jest również fizycznie miękki, wykazując twardość 3 w skali Mohsa. Jest stabilny w temperaturze pokojowej i nie reaguje z tlenem zawartym w powietrzu. Ale po podgrzaniu w obecności tlenu tworzy trójtlenek antymonu SbdwaLUB3.
Podobnie jest odporny na działanie słabych kwasów; ale gdy jest gorący, jest atakowany przez kwas azotowy i solny.
Antymon ma wiele zastosowań, między innymi jest stosowany w stopach z ołowiem i cyną, do produkcji akumulatorów samochodowych, materiałów o niskim współczynniku tarcia itp..
Ten metaloid ma rzadką właściwość zwiększania objętości po zestaleniu, dzięki czemu jego stopy całkowicie zajmują przestrzeń wykorzystywaną do formowania instrumentu, który ma być wyprodukowany..
Indeks artykułów
- 1 Historia jego odkrycia
- 1.1 Przed Chrystusem
- 1.2 Wprowadzenie terminu
- 1.3 Uzyskanie
- 2 Struktura antymonu
- 2.1 Allotropia
- 3 Właściwości
- 3.1 Masa atomowa
- 3.2 liczba atomowa
- 3.3 Konfiguracja elektroniczna
- 3.4 stopnie utlenienia
- 3.5 Opis fizyczny
- 3.6 Temperatura topnienia
- 3.7 Temperatura wrzenia
- 3.8 Gęstość
- 3.9 Ciepło topnienia
- 3.10 Ciepło parowania
- 3.11 Molowa pojemność cieplna
- 3.12 Elektroujemność
- 3.13 Promień atomowy
- 3.14 Twardość
- 3.15 Stabilność
- 3.16 Izotopy
- 3.17 Przewodnictwo elektryczne i cieplne
- 3.18 Reaktywność chemiczna
- 4 Zastosowania
- 4.1 Stopy
- 4.2 Ognioodporne
- 4.3 Pole elektroniki
- 4.4 Medycyna i weterynaria
- 4.5 Pigmenty i farby
- 4.6 Inne zastosowania
- 5 Ryzyka
- 6 Odnośniki
Historia jego odkrycia
pne
Istnieją dowody na to, że od 3100 roku pne siarczek antymonu był używany jako kosmetyk w Egipcie. W Mezopotamii, dzisiejszym Iraku, znaleziono pozostałości wazonu i inny artefakt, prawdopodobnie z okresu między 3000 a 2200 pne, w którym antymon został użyty do jego opracowania.
Wprowadzenie terminu
Rzymski uczony Pliniusz Starszy (23-79 ne) opisał zastosowanie antymonu, który nazwał stibius, w opracowaniu siedmiu leków w swoim Traktacie o historii naturalnej. Alchemik Abu Mussa Jahir Ibn Hayyan (721-815) przypisuje się wprowadzeniu terminu antymon, aby nazwać element.
Użył następującej etymologii: „anty” jako synonim negacji, a „mono” tylko. Następnie chciał podkreślić, że antymon występuje nie tylko w przyrodzie. Wiadomo już, że jest częścią minerałów siarczkowych, a także wielu innych pierwiastków.
Otrzymywanie
Uważa się, że grecki naturysta Pedanius Diascorides uzyskał czysty antymon poprzez ogrzewanie siarczku antymonu w strumieniu powietrza. Włoski metalurg Vannocio Biringucio w książce De la Pirotecnia (1540) opisuje metodę izolacji antymonu.
Niemiecki chemik Andreas Libavius (1615), używając stopionej mieszaniny żelaza, siarczku antymonu, soli i winianu potasu, osiągnął produkcję krystalicznego antymonu.
Pierwszy szczegółowy raport na temat antymonu został sporządzony w 1707 roku przez francuskiego chemika Nicolasa Lemery'ego (1645-1715) w jego książce Treatise on Antimony.
Struktura antymonu
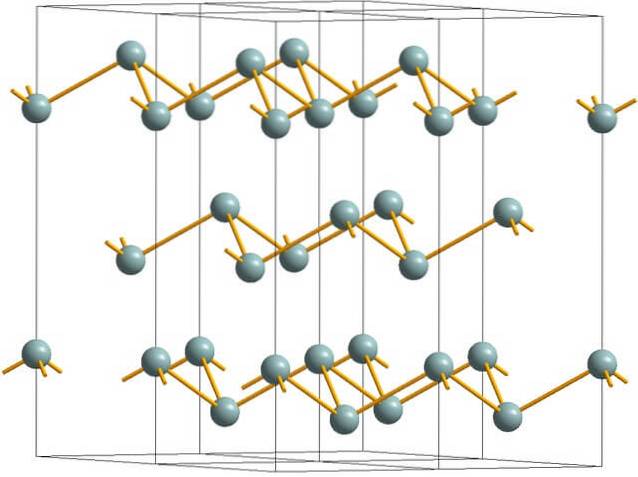
Górny obraz przedstawia pomarszczoną strukturę warstwową przejętą przez atomy arsenu. Jednak szarawy antymon, lepiej znany jako antymon metaliczny, również przyjmuje tę strukturę. Mówi się, że jest „pomarszczony”, ponieważ istnieją atomy Sb, które wznoszą się i opadają z płaszczyzny złożonej z warstwy.
Warstwy te, chociaż są odpowiedzialne za fotony, które z nimi oddziałują, świecą srebrzystym blaskiem, sprawiając, że antymon przechodzi jak metal, prawda jest taka, że łączące je siły są słabe; stąd widoczne fragmenty metalu Sb mogą być łatwo zmielone i kruche lub łuszczy się.
Ponadto atomy Sb w pomarszczonych warstwach nie są wystarczająco blisko, aby zgrupować swoje orbitale atomowe razem, tworząc pasmo umożliwiające przewodzenie elektryczne..
Patrząc na szarawą kulę pojedynczo, można zauważyć, że ma ona trzy wiązania Sb-Sb. Z wyższej płaszczyzny Sb można było zobaczyć w środku trójkąta, z trzema Sb umieszczonymi na jego wierzchołkach. Jednak trójkąt nie jest płaski i ma dwa poziomy lub piętra..
Boczne odwzorowanie takich trójkątów i ich wiązań tworzy pomarszczone warstwy, które ustawiają się w jednej linii, tworząc romboedryczne kryształy..
Alotropia
Opisana właśnie struktura odpowiada szarawemu antymonowi, najbardziej stabilnemu z jego czterech alotropów. Pozostałe trzy alotropy (czarny, żółty i wybuchowy) są metastabilne; to znaczy mogą istnieć w bardzo trudnych warunkach.
Niewiele jest informacji na temat ich konstrukcji. Wiadomo jednak, że czarny antymon jest amorficzny, więc jego struktura jest nieuporządkowana i skomplikowana..
Żółty antymon jest stabilny poniżej -90 ° C, zachowuje się jak pierwiastek niemetaliczny i można przypuszczać, że składa się z małych aglomeratów typu Sb4 (podobny do fosforu); po podgrzaniu przekształca się w czarny alotrop.
A jeśli chodzi o wybuchowy antymon, składa się on z galaretowatego osadu utworzonego na katodzie podczas elektrolizy wodnego roztworu halogenku antymonu..
Przy najmniejszym silnym tarciu lub uderzeniu miękkie ciało stałe uwalnia tyle ciepła, że eksploduje i stabilizuje się, gdy jego atomy przegrupowują się w romboedrycznej krystalicznej strukturze szaro-antymonu..
Nieruchomości
Masa atomowa
121,76 g / mol.
Liczba atomowa
51.
Elektroniczna Konfiguracja
[Kr] 4d105sdwa5 pkt3.
Stany utleniania
-3, -2, -1, +1, +2, +3, +4, +5.
Opis fizyczny
Lśniące srebrne ciało stałe, kruche, z łuszczącą się powierzchnią, z niebieskawym odcieniem. Może również występować jako czarny proszek.
Temperatura topnienia
630,63 ° C.
Temperatura wrzenia
1635 ºC.
Gęstość
-6,697 g / cm3 w temperaturze pokojowej.
-6,53 g / cm3 w stanie ciekłym, temperatura równa lub wyższa od temperatury topnienia.
Ciepło topnienia
19,79 kJ / mol.
Ciepło parowania
193,43 kJ / mol.
Molowa pojemność cieplna
25,23 J / mol K.
Elektroujemność
2,05 (w skali Paulinga).
Radio atomowe
140 po południu.
Twardość
To miękki element o twardości 3 w skali Mohsa, który można zarysować szkłem.
Stabilność
Jest stabilny w temperaturze pokojowej, nie ulega utlenieniu. Jest również odporny na atak kwasów.
Izotopy
Posiada dwa stabilne izotopy: 121Sb i 123Sb. Ponadto jest 35 izotopów promieniotwórczych. Izotop promieniotwórczy 125Sb to ten o najdłuższym okresie półtrwania: 2,75 roku. Generalnie izotopy promieniotwórcze emitują promieniowanie β+ i β-.
Przewodność elektryczna i cieplna
Antymon jest słabym przewodnikiem ciepła i elektryczności.
Reaktywność chemiczna
Nie może wypierać wodoru z rozcieńczonych kwasów. Tworzy kompleksy jonowe z kwasami organicznymi i nieorganicznymi. Metaliczny antymon nie reaguje z powietrzem, ale w wilgotnym powietrzu szybko przekształca się w tlenek..
Halogeny i siarczki łatwo utleniają antymon, jeśli proces zachodzi w podwyższonych temperaturach.
Aplikacje
Stopy
Antymon jest używany w stopie z ołowiem do produkcji płyt do akumulatorów samochodowych, poprawiając odporność płytek, a także właściwości ładunków..
Stop z ołowiem i cyną został użyty w celu poprawy właściwości spoin, a także pocisków smugowych i zapalników nabojowych. Jest również stosowany w stopach do powlekania kabli elektrycznych..
Antymon jest stosowany w stopach przeciwciernych, do produkcji stopów cyny i utwardzania o niskiej zawartości cyny do produkcji organów i innych instrumentów muzycznych..
Charakteryzuje się, podobnie jak woda, zwiększaniem objętości, gdy skrapla się; Dlatego antymon obecny w stopach z ołowiem i cyną wypełnia wszystkie przestrzenie w formach, poprawiając definicję konstrukcji wykonanych z tych stopów..
Ognioodporny
Trójtlenek antymonu jest używany do wytwarzania związków zmniejszających palność, zawsze w połączeniu z halogenowanymi środkami zmniejszającymi palność, bromkami i chlorkami..
Środki ogniochronne mogą reagować z atomami tlenu i rodnikami OH, co hamuje pożar. Te środki zmniejszające palność są stosowane w odzieży dziecięcej, zabawkach, samolotach i fotelikach samochodowych.
Są również dodawane do żywic poliestrowych i kompozytów z włókna szklanego na elementy używane jako osłony do lekkich silników lotniczych..
Związki antymonu, które są stosowane jako środki zmniejszające palność, obejmują: tlenochlorek antymonu, SbOCl; pentatlenek antymonu, SbO5; trichlorek antymonu, SbCl3; i trójtlenek antymonu SbO3.
Pole elektroniki
Wykorzystywany jest do produkcji półprzewodników, diod, detektorów średniej podczerwieni oraz do produkcji tranzystorów. Antymon o wysokiej czystości, stosowany w technologii półprzewodników, uzyskuje się poprzez redukcję związków antymonu wodorem.
Medycyna i weterynaria
Związki antymonu były stosowane w medycynie od czasów starożytnych jako środki wymiotne i przeciwpierwotniacze. Winian potasowo-potasowy (wymiotny kamień nazębny) był przez długi czas stosowany jako antyschistosom; stosowany dodatkowo jako środek wykrztuśny, napotny i wymiotny.
Sole antymonu były również stosowane w kondycjonowaniu skóry przeżuwaczy; takie jak aniomalina i tiomalan litowo-antymonowy.
Antymonian megluminy jest lekiem stosowanym w leczeniu leiszmaniozy w ogniskach zewnętrznych zwierząt domowych. Chociaż korzyści terapeutyczne były ograniczone.
Pigmenty i farby
Związki antymonu są używane do produkcji farb i środków zmętniających w emalii. Są również stosowane w pigmentach cynobrowych, żółtych i pomarańczowych, które są produktami powolnego utleniania siarczków antymonu..
Niektóre z jego soli organicznych (winianów) są wykorzystywane w przemyśle tekstylnym jako pomoc w wiązaniu niektórych barwników.
Siarczek antymonu był używany w starożytnym Egipcie jako kosmetyk do przyciemniania oczu.
Inne zastosowania
Niektóre sole antymonu są używane jako środki powlekające do usuwania mikroskopijnych pęcherzyków, które tworzą się na ekranach telewizorów. Jony antymonu oddziałują z tlenem, eliminując jego skłonność do tworzenia się pęcherzyków.
Siarczek antymonu (III) jest używany w główkach niektórych zapałek bezpiecznych. Siarczek antymonu służy również do stabilizacji współczynnika tarcia materiałów stosowanych w samochodowych klockach hamulcowych..
Izotop 124Sb wraz z berylem jest używany jako źródło neutronów o średniej energii 24 keV. Ponadto antymon jest używany jako katalizator w produkcji tworzyw sztucznych..
Ryzyka
Jest to element kruchy, więc podczas obchodzenia się z nim może powstawać zanieczyszczający pył z otoczenia. U pracowników narażonych na pył antymonu obserwowano zapalenie skóry, zapalenie nerek, zapalenie górnych dróg oddechowych i zapalenie spojówek..
Pneumokonioza, czasami połączona z obturacyjnymi zmianami w płucach, była opisywana po długotrwałym narażeniu.
Trójtlenek antymonu może powodować zagrażające życiu uszkodzenie czynności serca.
U osób narażonych na ten pierwiastek obserwowano przemijające krostkowe infekcje skóry..
Ciągłe przyjmowanie małych dawek tego metalu może powodować biegunkę, wymioty i wrzody żołądka. Podobnie, maksymalne dopuszczalne stężenie w powietrzu wynosi 0,5 mg / m3.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Manny. (11 marca 2009). Antymon żółty i antymon wybuchowy. Odzyskany z: antimonyproperties.blogspot.com
- Prof. Ernst Cohen i J. C. Van Den Bosch. (1914). Alotropia antymonu. Postępowanie Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antymon. Odzyskane z: en.wikipedia.org
- Advameg, Inc. (2019). Antymon. Odzyskany z: chemistryexplained.com
- Sable Mc'Oneal. (15 września 2018). Chemia: właściwości i zastosowanie Sb-antymonu. Odzyskany z: medium.com



Jeszcze bez komentarzy