
Struktura chemiczna, właściwości i zastosowania węglika krzemu

Plik Węglik krzemu Jest to kowalencyjne ciało stałe składające się z węgla i krzemu. Ma dużą twardość o wartości od 9,0 do 10 w skali Mohsa, a jego wzór chemiczny to SiC, co może sugerować, że węgiel jest związany z krzemem wiązaniem kowalencyjnym potrójnym, z ładunkiem dodatnim (+) na Si i ładunek ujemny (-) na węglu (+Tak≡C-).
W rzeczywistości wiązania w tym związku są zupełnie inne. Został odkryty w 1824 roku przez szwedzkiego chemika Jön Jacoba Berzeliusa podczas próby syntezy diamentów. W 1893 roku francuski naukowiec Henry Moissani odkrył minerał, którego skład zawierał węglik krzemu.

Odkrycia dokonano podczas badania próbek skał z krateru meteorytu w Devil's Canyon w USA. Nazwał ten minerał moissanitem. Z drugiej strony Edward Goodrich Acheson (1894) stworzył metodę syntezy węglika krzemu, przereagowania piasku lub kwarcu o wysokiej czystości z koksem naftowym..
Goodrich nazwał otrzymany produkt karborundem (lub karborundem) i założył firmę zajmującą się produkcją materiałów ściernych.
Indeks artykułów
- 1 Struktura chemiczna
- 2 Właściwości
- 2.1 Właściwości ogólne
- 2.2 Właściwości termiczne
- 2.3 Właściwości mechaniczne
- 2.4 Właściwości elektryczne
- 3 Zastosowania
- 3.1 Jako materiał ścierny
- 3.2 W postaci strukturalnej ceramiki
- 3.3 Inne zastosowania
- 4 Odnośniki
Struktura chemiczna
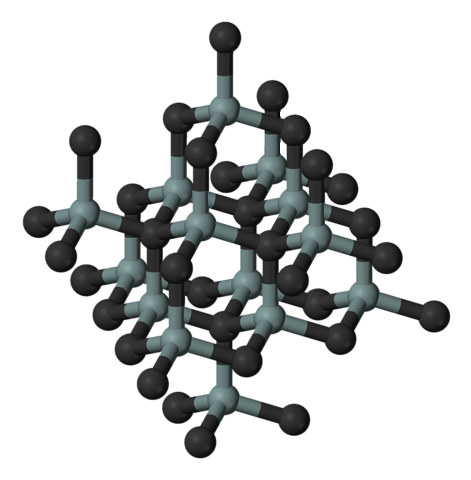
Powyższy obrazek ilustruje sześcienną i krystaliczną strukturę węglika krzemu. Ten układ jest taki sam jak w przypadku diamentu, pomimo różnic w promieniach atomów między C i Si..
Wszystkie wiązania są silnie kowalencyjne i kierunkowe, w przeciwieństwie do jonowych ciał stałych i ich oddziaływań elektrostatycznych.
SiC tworzy czworościany molekularne; to znaczy wszystkie atomy są związane z czterema innymi. Te czworościenne jednostki są połączone ze sobą wiązaniami kowalencyjnymi, przyjmując warstwowe struktury krystaliczne..
Ponadto warstwy te mają własne układy kryształów, które są trzech typów: A, B i C..
Oznacza to, że warstwa A różni się od B, a druga od C. Tak więc kryształ SiC składa się z ułożenia szeregu warstw, co jest zjawiskiem znanym jako politypizm..
Na przykład sześcienny poltyp (podobny do diamentu) składa się ze stosu warstw ABC i dlatego ma krystaliczną strukturę 3C..
Inne stosy tych warstw również generują inne struktury, między tymi romboedrycznymi i sześciokątnymi politypami. W rzeczywistości krystaliczne struktury SiC stają się „krystalicznym zaburzeniem”.
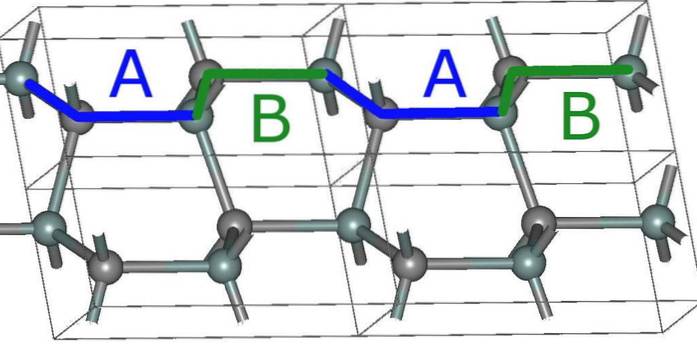
Najprostsza struktura heksagonalna SiC, 2H (górne zdjęcie), powstaje w wyniku ułożenia warstw w sekwencję ABABA ... Po każdych dwóch warstwach sekwencja się powtarza i stąd pochodzi cyfra 2.
Nieruchomości
Właściwości ogólne
Masa cząsteczkowa
40,11 g / mol
Wygląd
Różni się w zależności od metody otrzymywania i użytych materiałów. Mogą to być kryształy: żółte, zielone, czarno-niebieskie lub opalizujące.
Gęstość
3,16 g / cm3
Temperatura topnienia
2830 ºC.
Współczynnik załamania światła
2.55.
Kryształy
Istnieje polimorfizm: sześciokątne kryształy αSiC i sześcienne kryształy βSiC.
Twardość
9 do 10 w skali Mohsa.
Odporność na środki chemiczne
Jest odporny na działanie silnych kwasów i zasad. Dodatkowo węglik krzemu jest chemicznie obojętny..
Właściwości termiczne
- Wysoka przewodność cieplna.
- Wytrzymuje wysokie temperatury.
- Wysoka przewodność cieplna.
- Niski współczynnik liniowej rozszerzalności cieplnej, dzięki czemu wytrzymuje wysokie temperatury przy małej rozszerzalności.
- Odporny na szok termiczny.
Właściwości mechaniczne
- Wysoka odporność na ściskanie.
- Odporny na ścieranie i korozję.
- Jest to lekki materiał o dużej wytrzymałości i odporności.
- Zachowuje elastyczność w wysokich temperaturach.
Nieruchomości elektryczny
Jest to półprzewodnik, który może spełniać swoje funkcje w wysokich temperaturach i ekstremalnych napięciach, przy niewielkim rozpraszaniu swojej mocy na pole elektryczne..
Aplikacje
Jako materiał ścierny
- Węglik krzemu jest półprzewodnikiem zdolnym do wytrzymania wysokich temperatur, wysokich gradientów napięcia lub pola elektrycznego 8 razy bardziej niż krzem. Z tego powodu znajduje zastosowanie przy budowie diod, tranzystorów, tłumików oraz wysokoenergetycznych urządzeń mikrofalowych..
- Z tego związku wykonano diody elektroluminescencyjne (LED) oraz detektory do pierwszych radiotelefonów (1907). Obecnie w produkcji żarówek LED węglik krzemu został zastąpiony azotkiem galu, który emituje od 10 do 100 razy jaśniejsze światło..
- W układach elektrycznych węglik krzemu jest używany jako piorunochron w systemach elektroenergetycznych, ponieważ może regulować jego rezystancję poprzez regulację napięcia na nim..
W postaci strukturalnej ceramiki
- W procesie znanym jako spiekanie cząstki węglika krzemu - a także cząstki towarzyszące - są podgrzewane do temperatury niższej niż temperatura topnienia tej mieszaniny. W ten sposób zwiększa odporność i wytrzymałość przedmiotu ceramicznego poprzez tworzenie silnych wiązań między cząstkami..
- Ceramika strukturalna z węglika krzemu ma szeroki zakres zastosowań. Stosowane są w hamulcach tarczowych i sprzęgłach samochodowych, w filtrach cząstek stałych oraz jako dodatek do olejów zmniejszający tarcie.
- Zastosowania ceramiki strukturalnej z węglika krzemu stały się powszechne w częściach narażonych na działanie wysokich temperatur. Na przykład dotyczy to gardzieli wtryskiwaczy rakietowych i rolek pieców..
- Połączenie wysokiej przewodności cieplnej, twardości i stabilności w wysokiej temperaturze sprawia, że komponenty do rur wymienników ciepła są produkowane z węglika krzemu..
- Ceramika strukturalna jest stosowana w wtryskiwaczach do piaskowania, uszczelnieniach samochodowych pomp wodnych, łożyskach i matrycach do wytłaczania. Jest to również materiał na tygle, używany do wytapiania metali..
- Wchodzi w skład elementów grzejnych stosowanych przy wytopie szkła i metali nieżelaznych oraz przy obróbce cieplnej metali.
Inne zastosowania
- Może być stosowany do pomiaru temperatury gazów. W technice znanej jako pirometria, włókno z węglika krzemu jest podgrzewane i emituje promieniowanie, które jest skorelowane z temperaturą w zakresie 800-2500 ºK..
- Jest stosowany w elektrowniach jądrowych, aby zapobiec wyciekowi materiału powstałego w wyniku rozszczepienia.
- Przy produkcji stali jest używany jako paliwo.
Bibliografia
- Nicholas G. Wright, Alton B. Horsfall. Węglik krzemu: powrót starego przyjaciela. Material Matters Volume 4 Article 2. Pobrane 5 maja 2018 z: sigmaaldrich.com
- John Faithfull. (Luty 2010). Kryształy karborundu. Pobrane 5 maja 2018 z: commons.wikimedia.org
- Charles & Colvard. Polytypizm i Moissanit. Pobrane 5 maja 2018 r. Z: moissaniteitalia.com
- Materiałoznawca. (2014). SiC2HstructureA. [Postać]. Pobrane 5 maja 2018 z: commons.wikimedia.org
- Wikipedia. (2018). Węglik krzemu. Pobrane 5 maja 2018 r. Z: en.wikipedia.org
- Navarro SiC. (2018). Węglik krzemu. Pobrane 5 maja 2018 r.Z: navarrosic.com
- Uniwersytet Barceloński. Węglik krzemu, SiC. Pobrane 5 maja 2018 r. Z: ub.edu
- CarboSystem. (2018). Węglik krzemu. Pobrane 5 maja 2018 r. Z: carbosystem.com


Jeszcze bez komentarzy