
Struktura azydku sodu (NaN3), właściwości, zastosowania, zagrożenia

Plik Azydku sodowego jest krystaliczną nieorganiczną substancją stałą utworzoną przez jon sodu Na+ i jon azydkowy N3-. Jego wzór chemiczny to NaN3. Związek NaN3 jest solą sodową kwasu azotowodorowego HN3. NaN3 jest bezbarwną lub białą krystaliczną substancją stałą.
Chociaż jest to bardzo toksyczny związek, jednym z jego najbardziej rozpowszechnionych zastosowań są poduszki powietrzne, które napełniają się natychmiast podczas wypadków samochodowych. Służy również do szybkiego nadmuchiwania zjeżdżalni awaryjnych w samolotach. Jednak jego stosowanie jest obecnie mocno kwestionowane w obu przypadkach ze względu na jego toksyczność..

Jest używany w laboratoriach badań chemicznych do syntezy różnych typów związków oraz w laboratoriach biochemicznych do badań bakterii, grzybów, ssaków lub komórek ludzkich..
W niektórych laboratoriach służy do sterylizacji materiałów lub sprzętu, ale niektóre rodzaje mikroorganizmów są odporne na jego działanie biobójcze.
Jest również stosowany w rolnictwie do eliminacji pasożytów z gleby lub w przemyśle drzewnym, aby zapobiec plamieniu drewna sosnowego przez grzyby.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3.6 Stałe dysocjacji
- 3.7 Właściwości chemiczne
- 3.8 Właściwości biochemiczne
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 W pojazdach silnikowych i samolotach
- 5.2 W przemyśle chemicznym
- 5.3 W rolnictwie
- 5.4 Przy wytwarzaniu innych związków chemicznych
- 5.5 W przemyśle materiałów wybuchowych
- 5.6 W laboratoriach biochemicznych
- 5.7 Do różnych zastosowań
- 6 Ryzyka
- 7 Referencje
Struktura
Azydek sodu NaN3 jest utworzony przez kation sodu Na+ i anion azydkowy N.3-.
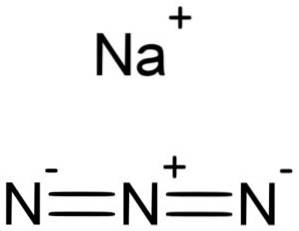
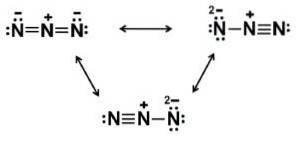
Jon azydkowy N3- Składa się z 3 atomów azotu (N) połączonych ze sobą wiązaniami kowalencyjnymi, które mogą być pojedyncze, podwójne lub potrójne, ponieważ elektrony są wspólne dla trzech.
Wspomniany anion ma strukturę liniową, to znaczy trzy atomy azotu ułożone w linii prostej. Dodatkowo konstrukcja jest symetryczna.
Nomenklatura
- Azydku sodowego
- Azydku sodowego
Nieruchomości
Stan fizyczny
Bezbarwna do białej krystalicznej substancji stałej. Sześciokątne kryształy.
Waga molekularna
65,01 g / mol
Temperatura topnienia
Rozkłada się w temperaturze 275 ºC.
Gęstość
1,846 g / cm3 przy 20 ºC
Rozpuszczalność
Bardzo dobrze rozpuszcza się w wodzie: 41,7 g / 100 ml w temperaturze 17 ºC. Jest słabo rozpuszczalny w etanolu i nierozpuszczalny w eterze etylowym.
Stałe dysocjacji
Ma pKb z 9.3. Wodne roztwory zawierają NH3, który szybko przedostaje się do środowiska w temperaturze 37 ºC.
Właściwości chemiczne
NaN3 działa silnie korodująco na aluminium i umiarkowanie w stosunku do miedzi i ołowiu.
Według pewnego źródła azydek sodu nie jest wybuchowy. Rozkłada się płynnie i całkowicie po podgrzaniu do 300 ° C lub więcej, tworząc sód metaliczny Na i azot gazowy Ndwa.
2 NaN3 → 2 Na + 3 N.dwa↑
Jest środkiem azotującym, czyli służy do azotowania lub dodawania azotu do innych związków chemicznych lub do powierzchni materiałów np. Stali..
Jest stabilny w wodzie obojętnej lub alkalicznej przy braku światła. Rozkłada się pod wpływem promieniowania słonecznego.
Właściwości biochemiczne
Azydek sodu hamuje enzym zwany oksydazą cytochromową, który znajduje się w mitochondriach komórek i jest w tym istotnie zaangażowany w oddychanie i wytwarzanie energii.
Jego działanie zapobiega wytwarzaniu ATP, kluczowego związku w czynnościach komórkowych, powodując degradację lub uszkodzenie komórki.
W przypadku spożycia, wdychania lub kontaktu z azydkiem sodu jest bardzo toksyczny i może być śmiertelny..
Otrzymywanie
Reaguje amoniak NH3 z sodem metalicznym Na w temperaturze 350 ° C w zamkniętym pojemniku stalowym, uzyskując amidek sodu NaNHdwa.
Amidek sodu NaNHdwa reaguje z podtlenkiem azotu NdwaLub w 230 ° C w reaktorze niklowym, w wyniku czego powstaje mieszanina azydku sodu NaN3, wodorotlenek sodu NaOH i amoniak NH3.
2 NaNHdwa + NdwaO → NaN3 + NaOH + NH3
Można go również otrzymać w reakcji amidku sodu z azotanem sodu NaNO3 przy 175 ºC:
3 NaNHdwa + Starszy brat3 → NaN3 + 3 NaOH + NH3
W celu oczyszczenia azydku do mieszaniny dodaje się wodę, przemywa kryształy azydku, a następnie odparowuje wodę. Pozostały materiał krystaliczny to azydek sodu NaN3 który jest następnie suszony w temperaturze 110 ° C.
Aplikacje
W pojazdach mechanicznych i samolotach
Azydek sodu jest od dawna stosowany w przemyśle motoryzacyjnym jako generator azotu do szybkiego napełniania poduszek powietrznych. poduszki powietrzne) bezpieczeństwo kierownic samochodów osobowych i ciężarowych w przypadku uderzenia.
Znajduje również zastosowanie w nadmuchiwanych zjeżdżalniach, które służą do szybkiej ucieczki z wnętrza samolotów, które wylądowały w sytuacjach awaryjnych..
W obu przypadkach mechanizm polega na działaniu iskry w celu wywołania natychmiastowej reakcji między azydkiem sodu a niektórymi związkami, w wyniku czego powstaje azot Ndwa i Na tlenek sodudwaLUB.
W tym zastosowaniu wymagane jest natychmiastowe uwolnienie zimnego i nietoksycznego gazu, więc azot jest najbardziej odpowiednim gazem..

Jednak zużycie to spada ze względu na toksyczność azydku sodu i zamiast tego stosowane są mniej toksyczne związki..
W przemyśle chemicznym
Stosowany jest jako opóźniacz w produkcji gumy gąbczastej, aby zapobiec koagulacji lateksu styrenowego lub butadienowego podczas przechowywania w kontakcie z metalami oraz do rozkładu azotynów w obecności azotanów.
W rolnictwie
Stosowany był w rolnictwie: jako biocyd i fumigant, jest również nematocydem, czyli jest stosowany do gleb w celu wyeliminowania nicieni, które są pasożytami atakującymi niektóre uprawy.

Działa również jako herbicyd i zapobiega gniciu owoców.
Ostatnio NaN3 został użyty do przygotowania nasion okry lub okry w celu zaobserwowania ich odporności na podmoknięcie.
Nasiona, do których wcześniej zastosowano NaN3 wygenerowane sadzonki, które lepiej znosiły warunki powodziowe niż nietraktowane, poprawiły wysokość roślin, zwiększyły liczbę liści i zwiększyły liczbę korzeni nawet przy nadmiarze wody.
W przygotowaniu innych związków chemicznych
Jest stosowany jako odczynnik chemiczny w syntezie związków organicznych, np. Do otrzymywania wielu azydków organicznych, takich jak azydek tosylu czy azydki trzeciorzędowych grup alkilowych, które są ważne w syntezie chemicznej.
Służy do przygotowania kwasu azotowodorowego (HN3) i czysty sód (Na).
W przemyśle materiałów wybuchowych
Azydek sodu NaN3 jest półproduktem do produkcji materiałów wybuchowych, ponieważ służy do wytwarzania azydku ołowiu Pb (N3)dwa. Ten ostatni jest związkiem, który eksploduje pod wpływem siły, dlatego jest używany do budowy urządzeń detonujących..

W laboratoriach biochemicznych
Azydek sodu jest stosowany, gdy wymagany jest sterylny sprzęt laboratoryjny, ponieważ jest zdolny do niszczenia różnych rodzajów mikroorganizmów.
Jest środkiem biobójczym. Jednak niektóre źródła podają, że niektóre rodzaje bakterii są odporne na jego działanie..
Osiąga się to poprzez blokowanie miejsca wiązania tlenu w oksydazie cytochromowej, która jest enzymem zaangażowanym w proces produkcji energii przez niektóre mikroorganizmy..
Jest stosowany w automatycznych licznikach krwi, a także do różnicowej selekcji bakterii oraz do konserwacji roztworów odczynników laboratoryjnych, ponieważ zapobiega rozwojowi niektórych mikroorganizmów w nich..
W różnych zastosowaniach
Azydek sodu jest stosowany w przemyśle drzewnym do zapobiegania rozwojowi brązowych plam grzybowych na drewnie sosnowym..
Został również użyty w japońskim przemyśle piwowarskim, aby zapobiec rozwojowi grzyba ciemniejącego piwo..
Ryzyka
Azydek sodu jest związkiem toksycznym, który hamuje enzym ważny dla oddychania i życia komórek ludzkich i zwierzęcych. Stwierdzono, że może poważnie wpływać na komórki tkanki naczyń krwionośnych mózgu.
Jego natychmiastowe działanie po połknięciu, inhalacji lub kontakcie ze skórą powoduje niebezpieczne obniżenie ciśnienia krwi, co może prowadzić do śmierci. Dlatego należy obchodzić się z nim z dużą ostrożnością..
Istnieją źródła informacji, które zwracają uwagę na poduszki powietrzne pojazdów, które są niszczone na wysypiskach śmieci.
W takich przypadkach osoby nieświadome niebezpieczeństwa mogą uzyskać dostęp do złóż NaN.3, jest to bardzo toksyczny związek. Ponadto istnieje niebezpieczeństwo zanieczyszczenia NaN3 gleba i woda.
Podobnie podczas wypadków, kolizji lub pożarów pojazdów ludzie mogą być narażeni na działanie NaN3 i może to być niedoceniane lub nieznane przez personel medyczny prowadzący pogotowie.
Zwrócono również uwagę na narażenie używającego go personelu laboratorium.
Bibliografia
- Vwioko, E.D. et al. (2019). Gruntowanie azydkiem sodu zwiększa tolerancję naprężeń spowodowanych wilgocią w Okrze (Abelmoschus esculentus). Agronomy 2019, 9, 670. Odzyskane z mdpi.com.
- Kho, D.T. et al. (2017). Śmierć komórek śródbłonka bariery krew-mózg na azydek sodu i jego produkty gazowe. Biosensors 2017, 7, 41. Odzyskane z mdpi.com.
- NAS. National Library of Medicine. (2019). Azydku sodowego. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Talavera, M. i in. (2019). Zarządzanie nicieniami na polach truskawek w południowej Hiszpanii. Agronomy 2019, 9, 252. Odzyskane z mdpi.com.
- Okano, T. i in. (1995). Mechanizm odrywania komórek od hydrofilowo-hydrofobowych powierzchni polimerowych o modulowanej temperaturze. W Biomaterials: Silver Jubilee Compendium. Odzyskany z sciencedirect.com.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. Tom A22. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Chang, S. i Lamm, S.H. (2003). Skutki narażenia na azydek sodu na zdrowie ludzi: przegląd i analiza literatury. Int J Toxicol 2003, 22 (3): 175–86. Odzyskany z ncbi.nlm.nih.gov.



Jeszcze bez komentarzy