
Struktura, właściwości, preparat, zastosowanie błękitu bromotymolowego
Plik błękit bromotymolowy Jest barwnikiem wrażliwym na pH otoczenia i był używany jako wskaźnik w wielu reakcjach laboratoryjnych. Wskaźnik to organiczny barwnik, którego kolor zależy od stężenia jonu H.3LUB+ lub pH pożywki. Poprzez kolor, który wyświetla, wskaźnik może wskazywać kwasowość lub zasadowość roztworu.
Błękit bromotymolowy ma aktywną skalę wskazań między pH 6,0 a 7,6. Przy pH podłoża niższym niż 6,5 wykazuje żółte zabarwienie. Kiedy pH pożywki waha się między 6,5 a 7,6, nabiera zielonego koloru. Przy pH większym niż 7,6 jego kolor jest niebieski.

Ta cecha sprawia, że wskaźnik ten jest bardzo przydatny, ponieważ można go stosować w skali pH zbliżonej do neutralności; dokładnie tam, gdzie zachodzą procesy fizjologiczne.
Jonizację błękitu bromotymolowego w roztworze wodnym można przedstawić w następujący sposób:
HIn (kolor żółty) + HdwaLUB <=> W- (kolor niebieski) + H.3LUB+
Kiedy wskaźnik jest protonowany (HIn), nabiera żółtego koloru; natomiast jeśli deprotonowany wskaźnik (In-) zmieni kolor na niebieski.
Indeks artykułów
- 1 Struktura chemiczna
- 1,1 zmiany pH
- 2 Właściwości
- 2.1 Nazwa chemiczna
- 2.2 Wzór cząsteczkowy
- 2.3 Masa cząsteczkowa
- 2.4 Wygląd fizyczny
- 2.5 Charakterystyka chemiczna
- 2,6 jonowa stała dysocjacji (Ka)
- 2.7 Aktywny zakres wskazań
- 2.8 Gęstość
- 2.9 Temperatura topnienia
- 2.10 Temperatura wrzenia
- 2.11 Rozpuszczalność
- 2.12 Stabilność
- 2.13 Absorpcja światła
- 3 Zastosowania i aplikacje
- 3.1 W badaniach metabolicznych
- 3.2 W położnictwie
- 3.3 Inne zastosowania
- 4 Przygotowanie
- 5 Referencje
Struktura chemiczna
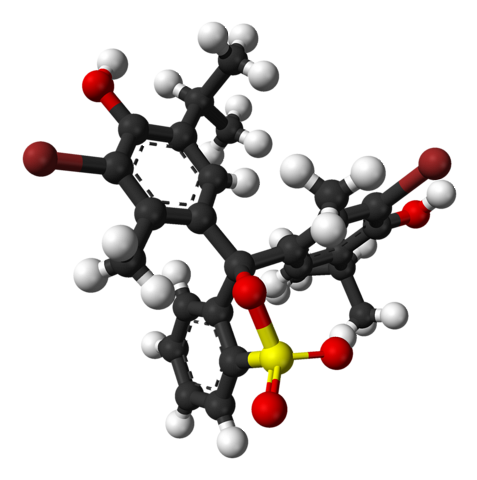
Górny obraz przedstawia strukturę błękitu bromotymolowego z modelem w postaci słupka i kuli przy pH niższym niż 7,1. Brązowe słupki odpowiadają atomom bromu, w sumie dwóm.
Każdy z trzech pierścieni aromatycznych tworzy razem z grupami metylowymi CH3, i tert-butyl, grupa tymolowa; a po połączeniu Br, stąd bierze się powód, dla którego nazywa się go `` bromotymolem ''.
Na dole pokazano grupę sulfonianową R-SO3-, z czerwonymi kulkami i żółtą. Ta grupa może być połączona przez atom O z centralnym atomem węgla, który łączy trzy pierścienie aromatyczne.
Zmiany pH
Chociaż ta struktura molekularna nie zmienia się radykalnie przy kwaśnym lub zasadowym pH, jej stany elektronowe ulegają zmianie, odzwierciedlając zmiany koloru roztworów.
Poniżej pH 7 wskaźnik ma kolor żółty i przyjmuje strukturę obrazu; ale jeśli pH stanie się zasadowe, grupy -OH deprotonuje się i może powstać podwójne wiązanie C = O.
W rezultacie sprzężony układ cząsteczki (układ wszystkich jej rezonansowych wiązań podwójnych) zmienia się na tyle, że elektrony nie absorbują już tych samych fotonów, a roztwór zmienia kolor z żółtego na niebieskawy..
Z drugiej strony, jeśli pH jest znacznie poniżej 7, kolor wskaźnika zmienia się z żółtego na czerwony. Tutaj zmiana w układzie sprzężonym jest spowodowana protonowaniem grup -OH do -OHdwa+. -
Zarówno w środowisku kwaśnym, jak i zasadowym, cząsteczka traci stabilność, pochłaniając fotony o niższej energii, aby umożliwić przejścia elektroniczne odpowiedzialne za kolory dostrzegane przez widzów..
A co z zielonym kolorem głównego obrazu? Gdy pH zbliża się do 7,1, niewielka część cząsteczek traci protony, dając niebieski kolor, który po zmieszaniu z żółtym daje kolor zielony..
Nieruchomości
Nazwa chemiczna
Błękit bromotymolowy lub 3,3'-dibromotymolsulfonaftaleina.
Formuła molekularna
do27H.28BrdwaLUB5S.
Waga molekularna
624,384 g / mol.
Wygląd fizyczny
Stały proszek o barwie od różowej do fioletowej.
Charakterystyka chemiczna
Działa jako słaby kwas w roztworze. Protonowany w środowisku kwaśnym nabiera żółtego zabarwienia, przy obojętnym pH jest zielony, a po deprotonowaniu w zasadowym pH jest niebieski.
Stała dysocjacji jonów (Ka)
7,9 x 10-8.
Aktywny zakres wskazań
pH 6,0 do 7,6. Wynika to z obecności atomów bromu, które działają w celu ekstrakcji elektronów i dwóch umiarkowanych grup donorów elektronów (podstawniki alkilowe).
Gęstość
1,25 g / cm3.
Temperatura topnienia
202 ° C (396 ° F).
Temperatura wrzenia
184,9 ° C.
Rozpuszczalność
Jest słabo rozpuszczalny w wodzie i oleju. Podobnie jest słabo rozpuszczalny w rozpuszczalnikach niepolarnych, takich jak benzen, toluen i ksylen, i praktycznie nierozpuszczalny w eterze naftowym. Jest rozpuszczalny w wodnych roztworach alkaliów i alkoholu.
Stabilność
Jest stabilny w temperaturze pokojowej i niekompatybilny z silnymi utleniaczami.
Absorpcja światła
Protonowana forma ma maksymalną absorpcję przy długości fali (λ) 427 nm, przepuszczając w ten sposób żółte światło w roztworach kwasów, a forma deprotonowana ma maksymalną absorpcję przy długości fali (λ) 602 nm, przepuszczając niebieskie światło. Przy alkalicznym pH.
Zastosowania i aplikacje
W badaniach metabolicznych
Błękit bromotymolowy jest używany w wielu procesach, w których dwutlenek węgla (COdwa), co w konsekwencji prowadzi do powstania kwasu węglowego (H.dwaWSPÓŁ3), który zakwasza medium; na co wskazuje zmiana zabarwienia błękitu bromotymolowego.
Jeśli osoba wykonuje ćwiczenia fizyczne i jest podłączona do rurki, która z kolei jest połączona z pojemnikiem z roztworem błękitu bromotymolowego, zaobserwuje się następujące zjawisko: w konsekwencji zwiększonej aktywności fizycznej i metabolizmu nastąpi wzrost produkcji COdwa.
COdwa będzie reagować z wodą, wytwarzając kwas węglowy, HdwaWSPÓŁ3, który następnie dysocjuje uwalniając jon H.+ i zakwaszenie podłoża. W konsekwencji błękit bromotymolowy nabiera żółtego koloru, podkreślając kwasowość podłoża..
W położnictwie
Błękit bromotymolowy jest stosowany w położnictwie do wczesnego pękania błon płodowych. Płyn owodniowy ma zwykle pH większe niż 7,7, więc błękit bromotymolowy zmieni kolor na niebieski, gdy wejdzie w kontakt z płynem wyciekającym z owodni..
Odczyn pochwy jest zwykle kwaśny, dlatego błękit bromotymolowy ma żółty odcień. Zmiana koloru na niebieski uwydatnia obecność płynu owodniowego w okolicy pochwy.
Inne zastosowania
Błękit bromotymolowy ma również zastosowanie w następującym sprzęcie i funkcjach:
-Czujniki optyczne
-Systemy detekcji spalania gazu
-W produkcji farb, zabawek, środków czystości, detergentów i tekstyliów
-Czujniki świeżości żywności
-Jako uchwyt do świeżego i zwietrzałego ryżu
-W wykrywaniu mikroorganizmów.
Jest również stosowany w analizie wzrostu bakterii, lekach psychoaktywnych i materiałach dentystycznych..
Przygotowanie
100 mg błękitu bromotymolowego rozpuszcza się w 100 ml rozcieńczonego alkoholu i w razie potrzeby przesącza. Przygotowuje się go również w następujący sposób: 50 mg błękitu bromotymolowego rozpuszcza się w mieszaninie 4 ml 0,02 N wodorotlenku sodu i 20 ml alkoholu, uzupełniając do 100 ml wodą.
Bibliografia
- Wikipedia. (2018). Błękit bromotymolowy. Odzyskane z: en.wikipedia.org
- Foist L. (2018). Błękit bromotymolowy: definicja, zastosowania i formuła. Nauka. Odzyskany z: study.com
- The Science Company. (2018). Wskaźnik pH błękitu bromotymolowego, 1 uncja. Odzyskany z: sciencecompany.com
- Spektrofotometryczne oznaczanie pK wskaźnika błękitu bromotymolowego. Odzyskany z: fch.upol.cz
- PubChem. (2018). Błękit bromotymolowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Królewskie Towarzystwo Chemii. (2015). Błękit bromotymolowy. ChemSpider. Źródło: chemspider.com
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.



Jeszcze bez komentarzy