
Charakterystyczne podstawy i przykłady

Plik podstawy są to wszystkie te związki chemiczne, które mogą przyjmować protony lub dawać elektrony. W naturze lub sztucznie istnieją zarówno zasady nieorganiczne, jak i organiczne. Dlatego jego zachowanie można przewidzieć dla wielu cząsteczek jonowych lub ciał stałych..
Jednak tym, co odróżnia bazę od reszty substancji chemicznych, jest jej wyraźna tendencja do oddawania elektronów w porównaniu np. Z gatunkami o niskiej gęstości elektronowej. Jest to możliwe tylko wtedy, gdy zlokalizowana jest para elektroniczna. W konsekwencji zasady mają regiony bogate w elektrony, δ-.

Jakie właściwości organoleptyczne pozwalają na identyfikację zasad? Są to na ogół substancje żrące, które przy kontakcie fizycznym powodują poważne oparzenia. Jednocześnie mają mydlany dotyk i łatwo rozpuszczają tłuszcze. Ponadto jej smak jest gorzki.
Gdzie oni są w życiu codziennym? Komercyjnym i rutynowym źródłem podkładów są środki czystości, od detergentów po mydła do rąk. Z tego powodu obraz bąbelków zawieszonych w powietrzu może pomóc zapamiętać podstawy, mimo że za nimi zachodzi wiele zjawisk fizykochemicznych..
Wiele zasad wykazuje zupełnie inne właściwości. Na przykład niektóre mają nieprzyjemny i silny zapach, taki jak aminy organiczne. Z drugiej strony inne, takie jak amoniak, są penetrujące i drażniące. Mogą to być również bezbarwne ciecze lub jonowe białe ciała stałe..
Jednak wszystkie zasady mają jedną wspólną cechę: reagują z kwasami, tworząc rozpuszczalne sole w polarnych rozpuszczalnikach, takich jak woda..
Indeks artykułów
- 1 Charakterystyka podstaw
- 1.1 Właściwości fizyczne
- 1.2 Wytrzymałość podstawy
- 1,3 pH większe niż 7
- 1.4 Zdolność do neutralizacji kwasów
- 1.5 Zdolność redukcji tlenków
- 1.6 Wydanie OH-
- 1.7 Mają atomy azotu lub podstawniki, które przyciągają gęstość elektronów
- 2 Przykłady podstaw
- 2.1 NaOH
- 2.2 CH3OCH3
- 2.3 Wodorotlenki alkaliczne
- 2.4 Zasady organiczne
- 2,5 NaHCO3
- 3 Odnośniki
Charakterystyka podstaw

Poza tym, co już zostało wspomniane, jakie szczególne cechy powinny mieć wszystkie bazy? Jak mogą przyjmować protony lub przekazywać elektrony? Odpowiedź leży w elektroujemności atomów cząsteczki lub jonu; wśród nich wszystkich dominuje tlen, zwłaszcza gdy występuje w postaci jonu hydroksylowego OH-.
Właściwości fizyczne
Bazy mają kwaśny smak i z wyjątkiem amoniaku są bezwonne. Jego konsystencja jest śliska i ma zdolność zmiany koloru papieru lakmusowego na niebieski, pomarańczowy metylowo-pomarańczowy na żółty, a fenoloftaleinę na fioletowy..
Siła bazy
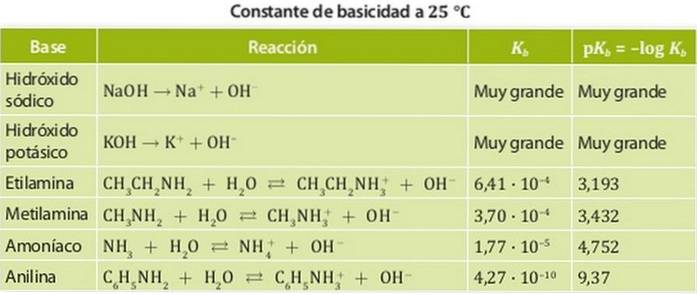
Zasady są podzielone na mocne i słabe zasady. Siła bazy jest związana z jej stałą równowagi, stąd w przypadku zasad te stałe nazywane są stałymi zasadowości Kb.
Zatem silne zasady mają dużą stałą zasadowości, więc mają tendencję do całkowitej dysocjacji. Przykładami takich kwasów są zasady, takie jak wodorotlenek sodu lub potasu, których stałe zasadowości są tak duże, że nie można ich zmierzyć w wodzie..
Z drugiej strony, słaba zasada to taka, której stała dysocjacji jest niska, więc znajduje się w równowadze chemicznej.
Przykładami są amoniak i aminy, których stałe kwasowości są rzędu 10-4. Rysunek 1 przedstawia różne stałe kwasowości dla różnych zasad.
pH większe niż 7
Skala pH mierzy zasadowość lub kwasowość roztworu. Skala waha się od zera do 14. pH poniżej 7 jest kwaśne. PH większe niż 7 jest zasadowe. Punkt środkowy 7 reprezentuje neutralne pH. Obojętny roztwór nie jest kwaśny ani zasadowy.
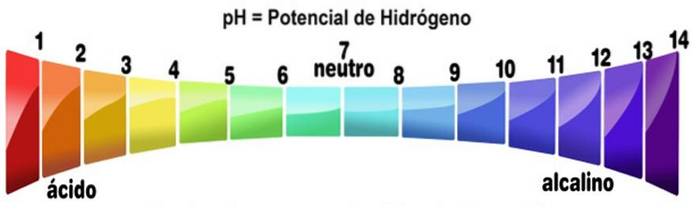
Skalę pH uzyskuje się jako funkcję stężenia H.+ w roztworze i jest do niego odwrotnie proporcjonalna. Zasady, zmniejszając stężenie protonów, zwiększają pH roztworu.
Zdolność do neutralizacji kwasów
Arrhenius w swojej teorii proponuje, że kwasy, będąc zdolnymi do generowania protonów, reagują z hydroksylem zasad, tworząc sól i wodę w następujący sposób:
HCl + NaOH → NaCl + HdwaLUB.
Ta reakcja nazywa się neutralizacją i jest podstawą techniki analitycznej zwanej miareczkowaniem..
Zdolność redukcji tlenków
Ze względu na ich zdolność do wytwarzania cząstek naładowanych, zasady są używane jako medium do przenoszenia elektronów w reakcjach redoks..
Zasady mają również tendencję do utleniania, ponieważ mają zdolność oddawania wolnych elektronów..
Zasady zawierają jony OH-. Mogą dawać elektrony. Aluminium to metal, który reaguje z zasadami.
2Al + 2NaOH + 6HdwaO → 2NaAl (OH)4+3Hdwa
Nie powodują korozji wielu metali, ponieważ metale raczej tracą niż przyjmują elektrony, ale zasady są silnie korodujące dla substancji organicznych, takich jak te, które tworzą błonę komórkową..
Reakcje te są zwykle egzotermiczne, co powoduje poważne oparzenia przy kontakcie ze skórą, dlatego z tego typu substancją należy obchodzić się ostrożnie. Rysunek 3 to wskaźnik bezpieczeństwa, gdy substancja jest korozyjna.

Uwalniają OH-
Na początek OH- Może być obecny w wielu związkach, głównie w wodorotlenkach metali, gdyż w towarzystwie metali ma tendencję do „wyrywania” protonów i tworzenia wody. Zatem zasadą może być dowolna substancja, która uwalnia ten jon w roztworze poprzez równowagę rozpuszczalności:
M (OH)dwa <=> Mdwa+ + 2OH-
Jeśli wodorotlenek jest bardzo rozpuszczalny, równowaga jest całkowicie przesunięta w prawo od równania chemicznego i mówimy o silnej zasadzie. M (OH)dwa , zamiast tego jest słabą zasadą, ponieważ nie uwalnia całkowicie swoich jonów OH- w wodzie. Pewnego razu OH- wyprodukowany może zneutralizować każdy kwas, który się wokół niego znajduje:
O- + HA => A- + H.dwaLUB
A więc OH- deprotonuje kwas hialuronowy do przemiany w wodę. Dlaczego? Ponieważ atom tlenu jest bardzo elektroujemny, a także ma nadmierną gęstość elektronów z powodu ładunku ujemnego.
O ma trzy pary wolnych elektronów i może przekazać dowolny z nich częściowo dodatnio naładowanemu atomowi H, δ +. Podobnie, duża stabilność energetyczna cząsteczki wody sprzyja reakcji. Innymi słowy: H.dwaLub jest znacznie bardziej stabilny niż HA, a kiedy to prawda, nastąpi reakcja neutralizacji.
Zasady koniugatu
A co z OH- już-? Obie są zasadami, z tą różnicą, że A- jest podstawa koniugatu kwas HA. Ponadto A.- jest dużo słabszą bazą niż OH-. Stąd wyciąga się następujący wniosek: baza reaguje generując słabszą.
Baza Silny + Kwas Silny => Baza Słaby + Kwas Słaby
Jak widać z ogólnego równania chemicznego, to samo dotyczy kwasów.
Sprzężona zasada A- może deprotonować cząsteczkę w reakcji znanej jako hydroliza:
DO- + H.dwaLUB <=> HA + OH-
Jednak w przeciwieństwie do OH-, po zneutralizowaniu wodą ustanawia równowagę. Znowu dzieje się tak, ponieważ A.- jest to znacznie słabsza zasada, ale wystarczająca do zmiany pH roztworu.
Dlatego wszystkie te sole, które zawierają A.- są znane jako sole zasadowe. Przykładem tego jest węglan sodu NadwaWSPÓŁ3, który po rozpuszczeniu alkalizuje roztwór poprzez reakcję hydrolizy:
WSPÓŁ3dwa- + H.dwaLUB <=> HCO3- + O-
Mają atomy azotu lub podstawniki, które przyciągają gęstość elektronów
Zasada to nie tylko jonowe ciała stałe z anionami OH- w swojej sieci krystalicznej mogą mieć również inne atomy elektroujemne, takie jak azot. Te typy zasad należą do chemii organicznej, a do najpowszechniejszych należą aminy.
Co to jest grupa aminowa? R-NHdwa. Na atomie azotu znajduje się niedzielona para elektronowa, która może, podobnie jak OH-, deprotonuje cząsteczkę wody:
R-NHdwa + H.dwaLUB <=> RNH3+ + O-
Równowaga jest silnie przesunięta w lewo, ponieważ amina, chociaż zasadowa, jest znacznie słabsza niż OH-. Zauważ, że reakcja jest podobna do tej podanej dla cząsteczki amoniaku:
NH3 + H.dwaLUB <=> NH4+ + O-
Tylko aminy nie mogą prawidłowo utworzyć kationu, NH4+; chociaż RNH3+ jest kationem amonowym z monopodstawieniem.
Czy może reagować z innymi związkami? Tak, z każdym, kto ma wystarczająco kwaśny wodór, nawet jeśli reakcja nie zachodzi całkowicie. Oznacza to, że tylko bardzo silna amina reaguje bez ustanowienia równowagi. Podobnie aminy mogą przekazywać swoją parę elektronów innym gatunkom niż H (takim jak rodniki alkilowe: -CH3).
Bazy z aromatycznymi pierścieniami
Aminy mogą również mieć pierścienie aromatyczne. Jeśli para elektronów może zostać „utracona” wewnątrz pierścienia, ponieważ pierścień przyciąga gęstość elektronów, wówczas jego zasadowość zmniejszy się. Dlaczego? Ponieważ im bardziej zlokalizowana jest ta para w strukturze, tym szybciej będzie reagować z gatunkami ubogimi w elektrony.
Na przykład NH3 jest podstawowa, ponieważ jej para elektronów nie ma dokąd pójść. To samo dotyczy amin, niezależnie od tego, czy są one pierwszorzędowe (RNHdwa), wtórne (RdwaNH) lub trzeciorzędowe (R3N). Są one bardziej zasadowe niż amoniak, ponieważ oprócz tego, co zostało właśnie wyjaśnione, azot przyciąga wyższe gęstości elektronowe podstawników R, zwiększając w ten sposób δ-.
Ale gdy istnieje pierścień aromatyczny, ta para może wejść w rezonans, uniemożliwiając udział w tworzeniu wiązań z H lub innymi gatunkami. Dlatego aminy aromatyczne są zwykle mniej zasadowe, chyba że para elektronów pozostaje związana z azotem (jak w przypadku cząsteczki pirydyny).
Przykłady podstaw
NaOH
Wodorotlenek sodu jest jedną z najczęściej stosowanych zasad na świecie. Jego zastosowania są niezliczone, ale wśród nich możemy wymienić jego zastosowanie do zmydlania niektórych tłuszczów, a tym samym do wytwarzania zasadowych soli kwasów tłuszczowych (mydeł).
CH3OCH3
Strukturalnie może się wydawać, że aceton nie przyjmuje protonów (lub nie przekazuje elektronów), jednak tak jest, mimo że jest to bardzo słaba zasada. Dzieje się tak, ponieważ elektroujemny atom O przyciąga chmury elektronów grup CH.3, podkreślenie obecności dwóch par elektronów (: O :).
Wodorotlenki alkaliczne
Oprócz NaOH wodorotlenki metali alkalicznych są również mocnymi zasadami (z niewielkim wyjątkiem LiOH). Zatem wśród innych baz są następujące:
-KOH: wodorotlenek potasu lub potaż żrący, jest to jedna z najczęściej stosowanych baz w laboratorium lub w przemyśle, ze względu na dużą siłę odtłuszczania.
-RbOH: wodorotlenek rubidu.
-CsOH: wodorotlenek cezu.
-FrOH: wodorotlenek franka, którego zasadowość teoretycznie uważa się za jedną z najsilniejszych, jakie kiedykolwiek poznano.
Zasady organiczne
-CH3CHdwaNHdwa: etyloamina.
-LiNHdwa: amidek litu. Wraz z amidem sodu NaNHdwa, są jednymi z najsilniejszych zasad organicznych. W nich anion amidowy NHdwa- to zasada deprotonuje wodę lub reaguje z kwasami.
-CH3ONa: metanolan sodu. Tutaj podstawą jest anion CH3LUB-, które mogą reagować z kwasami dając metanol, CH3O.
-Odczynniki Grignarda: zawierają atom metalu i halogen, RMX. W tym przypadku rodnik R jest zasadą, ale nie tylko dlatego, że usuwa kwaśny wodór, ale dlatego, że oddaje parę elektronów, które dzieli z atomem metalu. Na przykład: bromek etylomagnezu, CH3CHdwaMgBr. Są bardzo przydatne w syntezie organicznej.
NaHCO3
Soda oczyszczona służy do neutralizacji kwasowości w łagodnych warunkach, na przykład w jamie ustnej, jako dodatek do past do zębów.
Bibliografia
- Merck KGaA. (2018). Bazy organiczne. Zaczerpnięte z: sigmaaldrich.com
- Wikipedia. (2018). Zasady (chemia). Zaczerpnięte z: es.wikipedia.org
- Chemia 1010. Kwasy i zasady: czym są i gdzie się znajdują. [PDF]. Zaczerpnięte z: cactus.dixie.edu
- Kwasy, zasady i skala pH. Zaczerpnięte z: 2.nau.edu
- Grupa Bodner. Definicje kwasów i zasad oraz rola wody. Zaczerpnięte z: chemed.chem.purdue.edu
- Chemia LibreTexts. Podstawy: właściwości i przykłady. Zaczerpnięte z: chem.libretexts.org
- Shiver & Atkins. (2008). Chemia nieorganiczna. Na Kwasy i zasady. (czwarta edycja). Mc Graw Hill.
- Helmenstine, Todd. (04 sierpnia 2018). Nazwy 10 baz. Odzyskany z: thinkco.com



Jeszcze bez komentarzy