
Historia, budowa, właściwości, zastosowania berylu
Plik beryl Jest to pierwiastek metaliczny należący do grupy 2 lub IIA układu okresowego. Jest to najlżejszy metal ziem alkalicznych z grupy i jest reprezentowany przez symbol Be. Jego atom i kation są również mniejsze niż jego kongenerów (Mg, Ca, Sr ...).
Ze względu na niezwykłą gęstość ładunku metal ten zwykle nie występuje w izolacji. Wiadomo, że zawiera go około 30 minerałów, wśród których są: beryl (3BeOAldwaLUB36SiOdwa2HdwaO), bertrandyt (4BeO.2SiOdwa.2HdwaO), chryzoberyl (BeAldwaLUB4) i fenaquita (Bedwatak4).

Szmaragd, kamień szlachetny, to odmiana berylu. Jednak czysty beryl nie jest tak uderzający; ma blady szarawy połysk (górne zdjęcie) i został uzyskany w postaci nasion lub pastylek do ssania.
Beryl posiada szereg charakterystycznych właściwości fizycznych. Ma niską gęstość; wysokie przewodnictwo cieplne i elektryczne, a także jego pojemność cieplna i odprowadzanie ciepła; nie jest metalem magnetycznym; a także ma odpowiednią kombinację sztywności i elastyczności.
Wszystkie te właściwości sprawiły, że beryl jest metalem o wielu zastosowaniach, od zastosowania w stopach z miedzią do produkcji narzędzi, po zastosowanie w rakietach, samolotach, samochodach, reaktorach jądrowych, sprzęcie rentgenowskim, rezonansie magnetycznym, itp.
Beryl ma 10 znanych izotopów, od 5Bądź 14Bądź, będąc 9Bądź jedyną stabilną. Podobnie jest bardzo toksycznym metalem, który szczególnie oddziałuje na układ oddechowy, więc jego stosowanie jest ograniczone..
Indeks artykułów
- 1 Historia jego odkrycia
- 2 Struktura berylu
- 3 Konfiguracja elektroniczna
- 4 Właściwości
- 4.1 Opis fizyczny
- 4.2 Temperatura topnienia
- 4.3 Temperatura wrzenia
- 4.4 Gęstość
- 4.5 Promień atomowy
- 4.6 Promień kowalencyjny
- 4.7 Objętość atomowa
- 4.8 Ciepło właściwe
- 4.9 Ciepło topnienia
- 4.10 Ciepło parowania
- 4.11 Elektroujemność
- 4.12 Potencjał standardowy
- 4.13 Prędkość dźwięku
- 4.14 Rozszerzalność cieplna
- 4.15 Przewodność cieplna
- 4.16 Właściwości chemiczne
- 5 Aplikacje
- 5.1 Rozwój narzędzi
- 5.2 Tworzenie luster
- 5.3 W promieniowaniu jonizującym
- 5.4 W sprzęcie wytwarzającym magnetyzm
- 5.5 Reaktory jądrowe
- 5.6 Osłona metalowa
- 6 Gdzie jest?
- 7 Ryzyka
- 8 Odniesienia
Historia jego odkrycia
Beryl został odkryty przez Louis-Nicolasa Vauguelina w 1798 roku jako składnik mineralny berylu oraz krzemian glinu i berylu.
Później niemiecki chemik Frederic Wöhler, w 1828 r., Zdołał wyodrębnić beryl poprzez reakcję potasu z chlorkiem berylu w tyglu platynowym..
Równocześnie i niezależnie, francuski chemik Antoine Bussy również osiągnął izolację berylu. Wöhler jako pierwszy zaproponował nazwę beryl dla metalu.
Obecną nazwę otrzymała w 1957 roku, ponieważ wcześniej była znana jako glukin, ze względu na słodki smak niektórych jego soli. Aby jednak uniknąć pomyłki z innymi związkami o słodkim smaku oraz z rośliną zwaną glukiną, zdecydowano się zmienić jej nazwę na beryl..
Struktura berylu
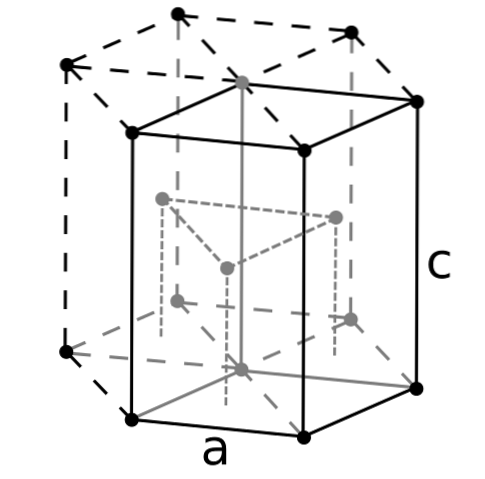
Beryl, jako najlżejszy z metali ziem alkalicznych, należy spodziewać się, że jego atomy będą miały najmniejszą objętość. Atomy berylu oddziałują ze sobą poprzez wiązanie metaliczne w taki sposób, że ich „morze elektronów” i odpychanie między jądrem kształtuje strukturę powstałego kryształu..
Następnie powstają czarne kryształy berylu. Kryształy te mają strukturę heksagonalną (górne zdjęcie), gdzie każdy atom Be ma sześć bocznych sąsiadów, a kolejne trzy w płaszczyznach powyżej i poniżej..
Ponieważ kryształy są czarne, warto wyobrazić sobie, że czarne punkty struktury heksagonalnej zostały zastąpione atomami berylu. Jest to jedna z najbardziej zwartych konstrukcji, jaką może przyjąć metal; i ma sens, że bardzo małe atomy Be są „ściśnięte” tak bardzo, aby uniknąć jak najmniejszej ilości pustek lub dziur między nimi.
Elektroniczna Konfiguracja
1sdwa2sdwa
Co jest równe 4 elektronom, z których 2 mają wartościowość. Jeśli elektron zostanie promowany na orbital 2p, będziemy mieć dwa orbitale hybrydowe sp. Zatem w związkach berylu mogą występować geometrie liniowe, X-Be-X; na przykład wyizolowana cząsteczka BeCldwa, Cl-Be-Cl.
Nieruchomości
Opis fizyczny
Błyszczące, kruche, stalowo szare ciało stałe.
Temperatura topnienia
1287 ºC.
Temperatura wrzenia
2471 ºC.
Gęstość
- 1,848 g / cm3 w temperaturze pokojowej.
- 1,69 g / cm3 do temperatury topnienia (stan ciekły).
Radio atomowe
112 wieczorem.
Promień kowalencyjny
90 po południu.
Objętość atomowa
5 cm3/ mol.
Ciepło właściwe
1824 J / gmol w 20 ° C.
Ciepło topnienia
12,21 kJ / mol.
Ciepło parowania
309 kJ / mol.
Elektroujemność
1,57 w skali Paulinga.
Potencjał standardowy
1,70 V..
Szybkość dźwięku
12,890 m / s.
Rozszerzalność cieplna
11,3 µm / m K w 25 ° C.
Przewodność cieplna
200 w / m K..
Właściwości chemiczne
Beryl pokryty jest warstwą tlenku berylu (BeO), która chroni go w powietrzu w temperaturze pokojowej. Utlenianie berylu zachodzi w temperaturach powyżej 1000 ° C, pochodzącego z produktów tlenku berylu i azotku berylu.
Jest również odporny na działanie kwasu azotowego 15 M. Ale rozpuszcza się w kwasie solnym i zasadach, takich jak wodorotlenek sodu..
Aplikacje
Produkcja narzędzi
Beryl tworzy stopy z miedzią, niklem i aluminium. W szczególności stop z miedzią daje narzędzia o dużej twardości i wytrzymałości, stanowiące zaledwie 2% masy stopu..
Narzędzia te nie wytwarzają iskier podczas uderzania w żelazo, co umożliwia ich stosowanie w środowiskach o dużej zawartości gazów palnych..
Ze względu na małą gęstość ma niewielką wagę, co w połączeniu ze swoją sztywnością pozwala na zastosowanie w samolotach kosmicznych, rakietach, pociskach i samolotach. Stop z berylem został użyty do produkcji części samochodowych. Był również używany do produkcji sprężyn.
Ze względu na dużą twardość, jaką beryl nadaje jego stopom, znalazły zastosowanie w hamulcach samolotów wojskowych..
Tworzenie luster
Beryl został użyty do produkcji luster ze względu na jego stabilność wymiarową i zdolność do polerowania. Lustra te są używane w satelitach i systemach kierowania ogniem. Ponadto znajdują zastosowanie w teleskopach kosmicznych.
W promieniowaniu jonizującym
Beryl jest pierwiastkiem o małej gęstości, więc można go uznać za przezroczysty dla promieni rentgenowskich, co pozwala na jego wykorzystanie w konstrukcji okienek rurek emitujących promieniowanie rentgenowskie, do zastosowań przemysłowych oraz w diagnostyce medycznej..
Beryl jest również stosowany w oknach detektorów promieniowania radioaktywnego..
W sprzęcie wytwarzającym magnetyzm
Wśród cech charakterystycznych berylu jest to, że nie jest on pierwiastkiem magnetycznym. Dzięki temu może być stosowany do budowy artykułów wyposażenia rezonansu magnetycznego, w których generowane są pola magnetyczne o dużym natężeniu, minimalizując wszelkie zakłócenia..
Reaktor nuklearny
Ze względu na wysoką temperaturę topnienia znalazł zastosowanie w reaktorach jądrowych i ceramice. Beryl jest używany jako moderator reakcji jądrowych oraz jako producent neutronów:
9Być + 4On (α) => 12C + n (neutron)
Szacuje się, że na milion atomów berylu bombardowanych cząstkami α powstaje do 30 milionów neutronów. Właśnie ta reakcja jądrowa pozwoliła na odkrycie neutronu.
James Chadwick zbombardował atomy berylu cząstkami α (He). Badacz zaobserwował uwalnianie cząstek subatomowych bez ładunku elektrycznego, co doprowadziło do odkrycia neutronów.
Metalowy ochraniacz
Dodanie pewnej ilości berylu do powierzchni metali, które mogą ulec utlenieniu, zapewnia im pewną ochronę. Na przykład zmniejsza się palność magnezu i przedłuża połysk stopów srebra.
Gdzie to się znajduje?
Beryl znajduje się w pegmatycie, związanym z miką, skaleniem i kwarcem. Stosując technikę flotacji, oddziela się mieszaninę berylu i skalenia. Następnie skaleń i beryl są zagęszczane i poddawane działaniu podchlorynu wapnia..
Po potraktowaniu kwasem siarkowym i sulfonianem potasu poprzez rozcieńczenie uzyskuje się flotację berylu, oddzielając go od skalenia.
Beryl jest traktowany fluorokrzemianem sodu i sodą w temperaturze 770 ° C w celu utworzenia fluorobylanu sodu, tlenku glinu i dwutlenku krzemu. Następnie wodorotlenek berylu wytrąca się z roztworu fluoroberynianu sodu za pomocą wodorotlenku sodu.
Fluorek berylu powstaje w wyniku reakcji wodorotlenku berylu z fluorowodorkiem amoniaku, w wyniku czego powstaje tetrafluroberynian amonu. Podgrzewa się go w celu utworzenia fluorku berylu, który jest poddawany działaniu magnezu w celu wyodrębnienia berylu..
Ryzyka
Beryl jako drobno rozdrobniony metal w postaci roztworów, suchego proszku lub dymu jest bardzo toksyczny i może powodować zapalenie skóry. Jednak największą toksyczność wywołuje inhalacja.
Początkowo beryl może wywoływać nadwrażliwość lub alergię, która może przekształcić się w berylozę lub przewlekłą chorobę berylu (CBD). Jest to poważna choroba, charakteryzująca się zmniejszeniem pojemności płuc.
Ostra choroba jest rzadka. W chorobach przewlekłych ziarniniaki tworzą się w całym ciele, zwłaszcza w płucach. Przewlekła beryloza powoduje postępującą duszność, kaszel i ogólne osłabienie (astenia).
Ostra beryloza może być śmiertelna. W beryliozie dochodzi do postępującej utraty funkcji oddechowej, ponieważ dochodzi do niedrożności przepływu gazów w drogach oddechowych i zmniejszonego natlenienia krwi tętniczej.
Bibliografia
- Królewskie Towarzystwo Chemii. (2019). Beryl. Odzyskany z: rsc.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Beryl. Baza danych PubChem. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Helmenstine, dr Anne Marie (15 marca 2019). Fakty dotyczące berylu. Odzyskany z: thinkco.com
- Wikipedia. (2019). Beryl. Odzyskane z: en.wikipedia.org
- Lenntech B. V (2019). Beryl-Be. Odzyskany z: lenntech.com
- Materio Corporation. (2019). Dowiedz się o pierwiastku beryl, odzyskanym z: beryllium.com
- D. Michaud. (12 kwietnia 2016). Problem przetwarzania i ekstrakcji berylu. 911 Metalurg. Odzyskane z: 911metallurgist.com
- Timothy P. Hanusa. (5 stycznia 2016). Beryl. Encyclopædia Britannica. Odzyskany z: britannica.com
- Lee S. Newman. (2014). Choroba berylu. Podręcznik MSD. Odzyskany z: msdmanuals.com



Jeszcze bez komentarzy