
Struktura, właściwości, zastosowanie borowodorku sodu (NaBH4)

Plik borowodorek sodowy jest nieorganicznym ciałem stałym, którego wzór chemiczny to NaBH4. Można go uznać za reprezentatywny dla borowodorków alkalicznych i jest z nich najpowszechniejszy. Jest to biała krystaliczna substancja stała.
W kontakcie z wodą NaBH4 może wytwarzać ciepło i wodór H.dwa który jest palny, dlatego należy obchodzić się z nim ostrożnie. Ze względu na łatwość, z jaką może generować jony wodorkowe H.-, borowodorek sodu jest związkiem umiarkowanie redukującym, dlatego jest szeroko stosowany w tym celu w reakcjach chemicznych.

Jego właściwości redukujące są również wykorzystywane w przemyśle papierniczym, ponieważ poprawia jasność i stabilność masy celulozowej i papieru, działając przeciw utlenianiu celulozy, głównego składnika papieru..
Ponieważ może on łatwo tworzyć wodór w obecności wody, zbadano również możliwość wykorzystania go jako odwracalnego źródła wodoru w ogniwach paliwowych..
Ma inne zastosowania, wszystkie oparte na jego właściwościach redukujących, na przykład w przemyśle farmaceutycznym.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości fizyczne
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura samozapłonu
- 3.4 Temperatura rozkładu
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 4 Właściwości chemiczne
- 5 Ryzyka
- 6 Otrzymywanie
- 7 zastosowań
- 7.1 W reakcjach chemicznych redukcji
- 7.2 Przy produkcji H2 w ogniwach paliwowych
- 7.3 W przemyśle celulozowo-papierniczym
- 7.4 W różnych zastosowaniach
- 8 Odniesienia
Struktura
Borowodorek sodu jest związkiem jonowym. Tworzy go anion borowodorkowy [BH4]- przyłączony do kationu sodu Na+.
Anion [BH4]- jest czworościenny.
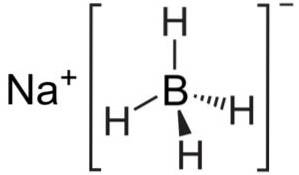
Jego struktura Lewisa jest następująca:
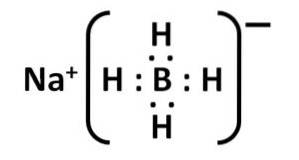
Nomenklatura
-Borowodorek sodowy
-Tetrahydroboran sodu
-Tetrahydruroboran sodu
Właściwości fizyczne
Stan fizyczny
Stały, biały krystaliczny.
Waga molekularna
37,84 g / mol
Temperatura samozapłonu
∼ 220 ºC
temperatura rozkładu
> 250 ºC
Gęstość
1,074 g / cm3 przy 20 ºC
Rozpuszczalność
NaBH4 jest dość dobrze rozpuszczalny w wodzie (55 g / 100 ml przy 25 ºC), gdzie jest częściowo hydrolizowany. Jest rozpuszczalny w tetrahydrofuranie (THF) i jest nierozpuszczalny w eterze dietylowym.
Właściwości chemiczne
Borowodorek sodu rozpuszcza się w wodzie, gdzie ulega początkowemu rozkładowi lub hydrolizie, która powoduje zasadowość roztworu, uniemożliwiając dalszą hydrolizę..
[BH4]- + H.dwaO → B (OH)3 + H.dwa↑ + OH-
Jest to wyjaśnione, ponieważ [BH4]- współdziała z H.+ wody, gdzie H.+ przyjmuje anion wodorkowy H.- tworząc H.dwa. Można powiedzieć, że BH3 konkurować z H.+ przez jon wodorkowy H.-.
W środowisku kwaśnym hydroliza jest zakończona z powodu dużej ilości jonów H.+.
NaBH4 jest stabilny w suchym powietrzu. Nie jest niestabilny.
Ze względu na zawartość jonów wodorkowych borowodorek sodu jest związkiem redukującym. Pozwala zredukować grupę karbonylową C = O do C-OH, czyli związków karbonylowych do alkoholi.
NaBH4 Sam w sobie nie redukuje wiązań podwójnych C = C, nawet sprzężonych z grupami karbonylowymi -C = C-C (= O)-.
Jednak w kontakcie z kwasami protonowymi (takimi jak HCl) lub kwasami Lewisa (takimi jak BCl3 lub AlCl3) powstaje diboran B.dwaH.6. A jeśli ta reakcja jest prowadzona w obecności związków organicznych z podwójnymi wiązaniami C = C, diboranu B.dwaH.6 wykonuje ich hydroborację.
W obecności odpowiednich katalizatorów i określonych warunków borowodorek sodu może redukować różnego rodzaju grupy funkcyjne.
Ryzyka
Ciepło reakcji hydrolizy w wodzie jest wystarczające do zapalenia powstającego w niej wodoru. Dlatego ważne jest, aby zachować ostrożność podczas obchodzenia się z nim.
NaBH4 łatwo się zapala i łatwo spala.
Otrzymywanie
Typowa reakcja wytwarzania NaBH4 następuje przez wodorek sodu NaH i B (OCH3)3 w temperaturze około 250 ºC:
4 NaH + B (OCH3)3 → NaBH4 + 3 NaOCH3
Aplikacje
W redukcji reakcji chemicznych
Ponieważ jest źródłem jonów H.-, NaBH4 Jest związkiem redukującym i służy do otrzymywania innych związków chemicznych. W tym celu jest stosowany w aprotonowych rozpuszczalnikach polarnych, to znaczy bez protonów H.+, takie jak dimetylosulfotlenek, heksametylofosforamid i dimetyloformamid.
Jest stosowany jako środek redukujący zarówno w organicznych, jak i nieorganicznych reakcjach chemicznych..
Pozwala na redukcję aldehydów do alkoholi pierwszorzędowych oraz ketonów do alkoholi drugorzędowych.
Redukuje również halogenki alkilowe do węglowodorów, takich jak jododekan do dekanu, kwas bromoundekanowy do kwasu undekanowego i chlorododekan do dodekanu..
Jeśli działa samodzielnie, podczas przeprowadzania redukcji nie wpływa na inne grupy funkcyjne, takie jak ester, kwas karboksylowy, nitryl i sulfon.
Jego właściwość polegająca na braku redukcji podwójnych wiązań C = C, nawet tych sprzężonych z grupami karbonylowymi -C = C-C (= O) -, umożliwia otrzymywanie nienasyconych alkoholi -C = C-CHdwa-O.
Aby zredukować nitrowane związki aromatyczne do odpowiadających im anilin, wymagana jest obecność katalizatorów, takich jak kobalt lub chlorek cyny. Redukuje disiarczki do tioli.
W obecności odpowiednich warunków i katalizatorów pozwala na redukcję kwasów karboksylowych, estrów, amidów, nitryli, imin, epoksydów, a nawet wiązań podwójnych i potrójnych.
W produkcji H.dwa w ogniwach paliwowych
NaBH4 można przekształcić w ogniwo paliwowe.
NaBH4 w obecności alkalicznego roztworu KOH lub NaOH hydrolizuje i wytwarza wodór H.dwa które można wykorzystać jako paliwo w ogniwie paliwowym z elektrolitem polimerowym.
Został również zbadany jako materiał magazynowy dla H.dwa odwracalnie.
Syntetyzowane są nanocząsteczki NaBH4 i stabilizowany środkiem powierzchniowo czynnym. Po zabiegu NiCldwa tworzy się warstwa lub powłoka ochronna, która reguluje uwalnianie Hdwa całkowicie odwracalne.
Ten nowy materiał nanometryczny pozwoliłby na użycie H.dwa jako czyste i odnawialne paliwo.

W przemyśle celulozowo-papierniczym
Borowodorek sodu służy do polepszania połysku i innych właściwości fizycznych masy celulozowej i papieru..
Degradacja celulozowej matrycy papieru zachodzi poprzez złożone procesy, które obejmują utlenianie. Grupy hydroksylowe ulegają utlenieniu do karbonylu i karboksylu, co prowadzi do odbarwienia papieru i pogorszenia jego właściwości fizycznych..
Podczas obróbki masy papierniczej lub papieru NaBH4, Zmniejsza to aldehydy i ketony do grup -OH bez wpływu na kwasowe grupy karboksylowe, poprawiając stabilność i połysk przy wyższych niż początkowe wartości..

W różnych zastosowaniach
Borowodorek sodu jest stosowany do oczyszczania ścieków, jako środek wzmacniający smak w przemyśle spożywczym i napojów, jako środek powlekający i do obróbki powierzchni, w produkcji tytoniu, w przemyśle farmaceutycznym, tekstylnym i przemysłowym..
Bibliografia
- Christian, M.L. i Aguey-Zinsou, K.-F. (2012). Strategia Core-Shell prowadząca do wysokiej odwracalnej pojemności magazynowania wodoru dla NaBH4. ACS Nano 2012, 6, 9, 7739-7751. Odzyskany z pubs.acs.org.
- Nora de Souza, M.V. i Alves V., T.R. (2006). Najnowsze metodologie, w których pośredniczy borowodorek sodu w redukcji różnych klas związków. Aplikacja Organometal. Chem. 2006; 20: 798-810. Odzyskany z onlinelibrary.wiley.com.
- Imamoto, T. (1991). Zmniejszenie. Borowodorek sodowy. W kompleksowej syntezie organicznej. Odzyskany z sciencedirect.com.
- Tang, L.C. (1986) Stabilization of Paper through Sodium Borohydride Treatment. W historycznych materiałach włókienniczych i papierniczych. Rozdział 24. Strony 427-441. Postępy w chemii, tom 212. Źródło: pubs.acs.org.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Morrison, Robert Thornton; i Boyd, Robert Neilson. 1992. Chemia organiczna. Prentice-Hall. ISBN 81-203-0765-8 .Linki zewnętrzne.
- NAS. National Library of Medicine. (2019). Borowodorek sodowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov.



Jeszcze bez komentarzy