
Struktura bromku litu, właściwości, zastosowania, zagrożenia
Plik bromek litu jest to obojętna sól metalu alkalicznego o wzorze chemicznym LiBr. Wzór wyraża, że jego krystaliczna substancja stała składa się z jonów Li+ i br- w stosunku 1: 1. Jego kryształy są białe lub jasnobeżowe. Jest bardzo dobrze rozpuszczalna w wodzie, jest również solą dość higroskopijną..
Ta ostatnia właściwość pozwala na zastosowanie go jako osuszacza w systemach klimatyzacyjnych i chłodniczych. Podobnie bromek litu był stosowany od początku XX wieku w leczeniu niektórych zaburzeń zdrowia psychicznego, a jego stosowanie zaniechano ze względu na niewłaściwe użycie soli.
LiBr jest wytwarzany przez obróbkę węglanu litu, LidwaWSPÓŁ3, z kwasem bromowodorowym. Po podgrzaniu medium wytrąca się z wodnego roztworu w postaci hydratu..
Sól ta podrażnia skórę i oczy przy kontakcie, a przy wdychaniu powoduje podrażnienie dróg oddechowych. Spożycie soli litu może powodować nudności, wymioty, biegunkę i zawroty głowy.
Indeks artykułów
- 1 Struktura bromku litu
- 1.1 Nawilża i szklanki
- 2 Właściwości
- 2.1 Masa cząsteczkowa
- 2.2 Wygląd
- 2.3 Zapach
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Rozpuszczalność w wodzie
- 2.7 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.8 Współczynnik załamania światła (ηD)
- 2.9 Pojemność cieplna
- 2.10 Standardowa entropia molowa (Sθ 298)
- 2.11 Temperatura zapłonu
- 2.12 Stabilność
- 2.13 Rozkład
- 2,14 pH
- 2.15 Reaktywność
- 2.16 Produkcja
- 3 Nazewnictwo
- 4 Zastosowania
- 4.1 Desykant
- 4.2 Włókna
- 4.3 Produkty farmaceutyczne
- 4.4 Uspokajające
- 5 Ryzyka
- 5.1 Toksyczność kontaktowa
- 5.2 Połknięcie
- 6 Odnośniki
Struktura bromku litu
Wzór LiBr wyjaśnia, że stosunek Li / Br jest równy 1; dla każdego kationu+ musi być anion Br- odpowiednik. Dlatego ten stosunek musi być utrzymywany na stałym poziomie we wszystkich rogach kryształu LiBr..
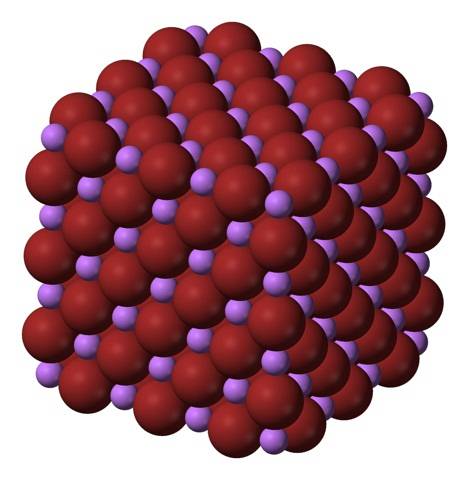
Jony litu+ i br- przyciągają się nawzajem, zmniejszając odpychanie między równymi ładunkami, tworząc w ten sposób sześcienny kryształ podobny do soli klejnotu; jest to izomorficzne z NaCl (górne zdjęcie). Zwróć uwagę, że sam cały zestaw ma geometrię sześcienną.
W tym krysztale Li+ są mniejsze i mają jasnofioletowy kolor; podczas gdy br- są bardziej obszerne i mają ciemnobrązowy kolor. Zaobserwowano, że każdy jon ma sześć sąsiadów, co oznacza to samo, co stwierdzenie, że mają one koordynację oktaedryczną: LiBr6 lub Li6Br; jednak jeśli weźmie się pod uwagę komórkę elementarną, stosunek Li / Br pozostaje 1.
To jest struktura krystaliczna, która została przyjęta przez LiBr. Jednak może również tworzyć inne rodzaje kryształów: wurzit, jeśli krystalizuje w niskich temperaturach (-50 ° C) na podłożu; lub sześcienny centrowany na ciele lub typu CsCl, jeśli sześcienny kryształ soli jest poddawany działaniu wysokiego ciśnienia.
Nawilża i okulary
Powyższe dotyczy bezwodnego LiBr. Sól ta jest higroskopijna i dlatego może pochłaniać wilgoć z otoczenia, wprowadzając cząsteczki wody do własnych kryształów. W ten sposób powstają hydraty LiBrnHdwaO (n = 1, 2, 3…, 10). Dla każdego hydratu struktura krystaliczna jest inna.
Na przykład badania krystalograficzne wykazały, że LiBrHdwaLub przyjmij strukturę podobną do perowskitu.
Kiedy te hydraty są w roztworze wodnym, mogą przechłodzić i zeszklić; to znaczy, przyjmują pozornie krystaliczną, ale molekularnie nieuporządkowaną strukturę. W takich warunkach wiązania wodorowe w wodzie stają się dość ważne..
Nieruchomości
Waga molekularna
88,845 g / mol.
Wygląd
Białe lub jasnobeżowe krystaliczne ciało stałe.
Zapach
Toaleta.
Temperatura topnienia
552 ° C (1026 ° F, 825 K).
Temperatura wrzenia
1256 ° C (2309 ° F, 1538 K).
Rozpuszczalność w wodzie
166,7 g / 100 ml w 20 ° C Zwróć uwagę na jego wysoką rozpuszczalność.
Rozpuszczalność w rozpuszczalnikach organicznych
Rozpuszczalny w metanolu, etanolu, eterze i acetonie. Słabo rozpuszczalny w pirydynie, związku aromatycznym i mniej polarny niż poprzednie.
Współczynnik załamania (ηD)
1,784.
Pojemność kaloryczna
51,88 J / mol K.
Standardowa entropia molowa (S.θ 298)
66,9 J / mol K.
punkt zapłonu
1265 ° C. Jest uważany za niepalny.
Stabilność
Stabilny. Forma bezwodna jest jednak wyjątkowo higroskopijna.
Rozkład
Rozkładając się przez ogrzewanie, wytwarza tlenek litu.
pH
Od pH 6 do 7 w roztworze wodnym (100 g / L, 20 ºC).
Reaktywność
Bromek litu nie reaguje w normalnych warunkach środowiskowych. Jednak wraz ze wzrostem temperatury mogą wystąpić silne reakcje z silnymi kwasami..
Podczas rozpuszczania w wodzie następuje wzrost temperatury, spowodowany ujemną entalpią hydratacji.
Produkcja
LiBr powstaje w wyniku reakcji wodorotlenku litu lub węglanu litu z kwasem bromowodorowym w reakcji neutralizacji:
LidwaWSPÓŁ3 + HBr => LiBr + COdwa + H.dwaLUB
Bromek litu otrzymywany jest w postaci hydratu. Aby otrzymać postać bezwodną, konieczne jest ogrzanie uwodnionej soli pod próżnią..
Nomenklatura
Nazwa „bromek litu” wywodzi się z faktu, że jest to metalohalogenek, nazwany tak zgodnie z nomenklaturą zapasów. Inne nazwy, równie ważne, ale rzadziej używane, to monobromek litu, zgodnie z systematyczną nomenklaturą; i bromek litu (unikalna wartościowość +1 dla litu), zgodnie z tradycyjną nomenklaturą.
Aplikacje
Środek pochłaniający wilgoć
LiBr to higroskopijna sól, tworząca skoncentrowaną solankę zdolną do pochłaniania wilgoci z powietrza w szerokim zakresie temperatur. Solanka ta jest używana jako osuszacz w systemach klimatyzacyjnych i chłodniczych..
Włókna
Służy do zwiększenia objętości wełny, sierści i innych włókien organicznych.
Dodatki farmaceutyczne
LiBr tworzy addukty z niektórymi związkami farmaceutycznymi, modulując ich działanie. Addukt to połączenie poprzez koordynację dwóch lub więcej cząsteczek bez powodowania zmian strukturalnych żadnej z połączonych cząsteczek.
Środek uspokajający
Bromek litu był po raz pierwszy stosowany jako środek uspokajający w niektórych zaburzeniach psychicznych i został wycofany w 1940 roku. Obecnie stosuje się węglan litu; ale w każdym razie lit jest pierwiastkiem, który wywiera działanie terapeutyczne w obu związkach.
Lit jest stosowany w leczeniu choroby afektywnej dwubiegunowej, będąc użytecznym w kontrolowaniu epizodów maniakalnych tego zaburzenia. Uważa się, że lit hamuje aktywność pobudzających neuroprzekaźników, takich jak dopamina i kwas glutaminowy.
Z drugiej strony zwiększa aktywność układu hamującego, w którym pośredniczy neuroprzekaźnik kwasu gamma-aminomasłowego (GABA). Działania te mogą stanowić podstawę terapeutycznego działania litu.
Ryzyka
Toksyczność kontaktowa
Podrażnienia i uczulenia skóry, alergie. Poważne uszkodzenie oczu lub podrażnienie oczu, dróg oddechowych, dróg nosowych i gardła.
Przyjmowanie pokarmu
Głównymi objawami po spożyciu bromku litu są: zaburzenia żołądkowo-jelitowe, wymioty i nudności. Inne niekorzystne skutki spożycia soli obejmują pobudzenie, skurcze i utratę przytomności..
Stan znany jako „bromizm” może wystąpić przy dawkach bromku litu większych niż 225 mg / dzień..
Niektóre z następujących oznak i objawów mogą wystąpić w żartach: zaostrzenie trądziku i utrata apetytu, drżenie, problemy z mową, apatia, osłabienie i maniakalne pobudzenie.
Bibliografia
- Formulacja chemiczna. (2019). Bromek litu. Odzyskany z: formulacionquimica.com
- David C. Johnson. (10 lipca 2008). Nowe zamówienie na bromek litu. Natura. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Strukturalne przejście fazowe w bromku litu: wpływ ciśnienia i temperatury. [PDF]. Odzyskany z: ncpcm.in
- Takamuku i in. (1997). Badania dyfrakcji rentgenowskiej na przechłodzonych wodnych roztworach bromku litu i jodku litu. Katedra Chemii, Wydział Nauk, Uniwersytet Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Japonia.
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Bromek litu. Baza danych PubChem, CID = 82050. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Bromek litu. Odzyskane z: en.wikipedia.org
- Królewskie Towarzystwo Chemii. (2019). Bromek litu. Chemspider. Źródło: chemspider.com


Jeszcze bez komentarzy