
Podgrzej podane wzory, jak je obliczyć i rozwiązane ćwiczenia
Plik wydzielane ciepło to transfer energii między dwoma ciałami w różnych temperaturach. Ten o najwyższej temperaturze oddaje ciepło temu, którego temperatura jest niższa. To, czy ciało oddaje, czy pochłania ciepło, jego temperatura lub stan fizyczny może się różnić w zależności od masy i właściwości materiału, z którego jest wykonane..
Dobrym przykładem jest parująca filiżanka kawy. Metalowa łyżka, za pomocą której miesza się cukier, nagrzewa się. Jeśli pozostanie w filiżance dostatecznie długo, kawa i metalowa łyżka wyrównają temperaturę: kawa ostygnie, a łyżka się nagrzeje. Część ciepła przedostanie się do otoczenia, ponieważ system nie jest izolowany.

Gdy temperatury się wyrównały, równowaga termiczna; równowaga cieplna.
Jeśli zrobiłeś ten sam test z plastikową łyżeczką, z pewnością zauważysz, że nie nagrzewa się tak szybko jak metalowa, ale w końcu również zrównoważy się z kawą i wszystkim wokół niej..
Dzieje się tak, ponieważ metal lepiej przewodzi ciepło niż plastik. Z drugiej strony kawa z pewnością oddaje ciepło w innym tempie niż gorąca czekolada czy inny napój. Zatem ciepło oddawane lub pochłaniane przez każdy przedmiot zależy od tego, z jakiego materiału lub substancji jest on wykonany..
Indeks artykułów
- 1 Z czego się składa i wzory
- 1.1 Różnica temperatur ΔT
- 1.2 Ciepło właściwe i pojemność cieplna substancji
- 2 Jak to obliczyć?
- 2.1 Kalorymetria
- 3 ćwiczenia rozwiązane
- 3.1 Ćwiczenie 1
- 3.2 Ćwiczenie 2
- 4 Odnośniki
Z czego się składa i formuły
Ciepło zawsze odnosi się do przepływu lub tranzytu energii między jednym obiektem a drugim, ze względu na różnicę temperatur.
Dlatego mówimy o cieple przenoszonym lub cieple pochłoniętym, ponieważ dodając lub pobierając w jakiś sposób ciepło lub energię, można modyfikować temperaturę elementu.
Ilość ciepła wydzielanego przez najgorętszy obiekt jest zwykle nazywana Q. Wartość ta jest proporcjonalna do masy wspomnianego obiektu. Ciało o dużej masie jest w stanie wytworzyć więcej ciepła niż inne ciało o mniejszej masie..
Różnica temperatur ΔT
Innym ważnym czynnikiem przy obliczaniu uwolnionego ciepła jest różnica temperatur odczuwana przez obiekt, który oddaje ciepło. Jest oznaczony jako ΔT i jest obliczany w ten sposób:
ΔT = T.fa - Tlub
Wreszcie ilość przekazywanego ciepła zależy również od charakteru i właściwości obiektu, które są podsumowywane ilościowo w stałej zwanej ciepło właściwe materiału, oznaczony jako do.
Ostatecznie wyrażenie na przenoszone ciepło jest następujące:
Qwydany = - m.c.ΔT
Poddanie się jest symbolizowane przez znak negatywny.
Ciepło właściwe i pojemność cieplna substancji
Ciepło właściwe to ilość ciepła potrzebna do podniesienia temperatury 1 g substancji o 1 ° C. Jest to nieodłączna właściwość materiału. Jego jednostki w układzie międzynarodowym to: dżul / kg. K (dżul między kilogramem a temperaturą w stopniach Kelvina).
Pojemność cieplna C jest pojęciem powiązanym, ale nieco innym, ponieważ w grę wchodzi masa obiektu. Pojemność cieplną definiuje się następująco:
C = mc
Jej jednostki w S.I. oni są Joule / K. Zatem uwolnione ciepło można również wyrazić równoważnie jako:
Q = -C. ΔT
Jak to obliczyć?
Aby obliczyć ciepło wydzielane przez obiekt, należy znać następujące kwestie:
- Ciepło właściwe substancji oddającej ciepło.
- Masa tej substancji
- Ostateczna temperatura do uzyskania
Specyficzne wartości ciepła dla wielu materiałów zostały określone eksperymentalnie i są dostępne w tabelach.
Kalorymetria
Teraz, jeśli ta wartość nie jest znana, można ją uzyskać za pomocą termometru i wody w termicznie izolowanym pojemniku: kalorymetrze. Schemat tego urządzenia pokazano na rysunku dołączonym do ćwiczenia 1.
Próbkę substancji o określonej temperaturze zanurza się we wcześniej odmierzonej ilości wody. Na podstawie uzyskanych wartości mierzona jest temperatura końcowa, a ciepło właściwe materiału jest określane..
Porównując wynik z wartościami tabelarycznymi, można dowiedzieć się, która to jest substancja. Ta procedura nazywa się kalorymetria.
Bilans cieplny jest przeprowadzany poprzez oszczędzanie energii:
Q wydany + Q wchłonięty = 0
Rozwiązane ćwiczenia
Ćwiczenie 1
Kawałek miedzi o masie 0,35 kg jest wprowadzany w temperaturze 150ºC w 500 ml wody o temperaturze 25ºC.
a) Ostateczna temperatura równowagi
b) Ile ciepła przepływa w tym procesie?
Dane
domiedź = 385 J / kg. ºC
dowoda = 4180 J / kg. ºC
Gęstość wody: 1000 kg / m3
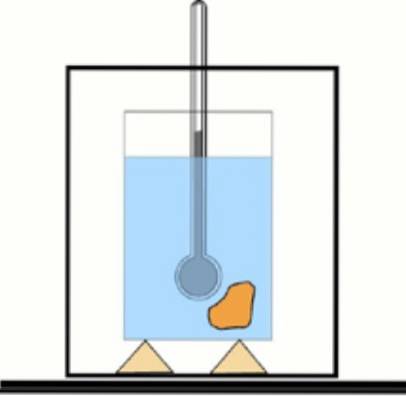
Rozwiązanie
a) Miedź oddaje ciepło, a woda je pochłania. Ponieważ system jest uważany za zamknięty, tylko woda i próbka wpływają na bilans cieplny:
Q wydany = Q zaabsorbowany
Z drugiej strony należy obliczyć masę 500 ml wody:
500 ml = 0,5 l = 0,0005 m3
Na podstawie tych danych obliczana jest masa wody:
masa = gęstość x objętość = 1000 kg / m3 . 0,0005 m3 = 0,5 kg
Podnosi się równanie na ciepło w każdej substancji:
Qwydany = -mmiedź . domiedź. ΔT = -0,35 kg. 385 J / kg ° C . (Tfa -150 ºC) = -134,75 (Tfa - 150) J.
Qzaabsorbowany = mwoda . dowoda. ΔT = 0,5 kg. 4186 J / kg. ºC. (T.fa -25 ºC) = 2093 (T.fa -25) J.
Porównując wyniki, mamy:
2093 (Tfa - 25) = -134,75 (T.fa - 150)
Jest to równanie liniowe z jednym niewiadomym, którego rozwiązanie jest następujące:
Tfa = 32,56 ° C
b) Ilość ciepła, które przepływa, to ciepło przekazane lub pochłonięte:
Q wydany = - 134,75 (32,56 - 150) J = 15823 J
Q zaabsorbowany = 2093 (32,56 - 25) J = 15823 J
Ćwiczenie 2
Kawałek miedzi o masie 100 g ogrzewa się w piecu w temperaturze T.lub a następnie jest wprowadzany do kalorymetru miedzianego o masie 150 g, zawierającego 200 g wody o temperaturze 16 ° C.Końcowa temperatura po osiągnięciu równowagi wynosi 38 ° C. Po zważeniu kalorymetru i jego zawartości okazuje się, że odparowało 1,2 g wody. temperatura początkowa Tlub?
Dane: utajone ciepło parowania wody wynosi Lv = 2257 kJ / kg
Rozwiązanie
To ćwiczenie różni się od poprzedniego, ponieważ należy wziąć pod uwagę, że kalorymetr również pochłania ciepło. Ciepło uwalniane przez kawałek miedzi jest inwestowane we wszystkie następujące elementy:
- Podgrzej wodę w kalorymetrze (200 g)
- Podgrzej miedź, z której wykonany jest kalorymetr (150 g)
- Odparuj 1,2 grama wody (energia jest również potrzebna do zmiany fazy).
Qwydany = -100 x 1 x 10 -3 kg. 385 J / kg. ºC. (38 - T.lub ) ºC = -38.5. (38 - T.lub) J.
Q wchłonięty przez kalorymetr = Q wchłaniana przez wodę + Q odparowanie + Q absorbowany przez miedź
0,2 kg 4186 J / kg ºC. (38 - 16 ºC) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg 0,385 J / kg ° C (38 - 16 ° C) =
18418,4 +2708,4 + 1270,5 J = 22397,3 J
W związku z tym:
-38.5. (38 - T.lub) = 22397,3
Tlub = 619,7 ° C
Można by również wziąć pod uwagę ciepło potrzebne do podgrzania 1,2 g wody do 100ºC, ale w porównaniu z tym jest to dość mała ilość..
Bibliografia
- Giancoli, D. 2006. Fizyka: Zasady z zastosowaniami. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fizyka: spojrzenie na świat. 6ta Wydanie skrócone. Cengage Learning. 156-164.
- Rex, A. 2011. Podstawy fizyki. Osoba. 309 - 332.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z fizyką współczesną. 14th. Ed. Tom 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Podstawy fizyki. 9na Cengage Learning.



Jeszcze bez komentarzy