
Właściwości, zastosowania i przykłady chlorowcowanych pochodnych

Plik pochodne chlorowcowane to wszystkie te związki, które mają atom halogenu; to znaczy dowolny z elementów z grupy 17 (F, Cl, Br, I). Pierwiastki te różnią się od pozostałych tym, że są bardziej elektroujemne, tworząc różnorodność nieorganicznych i organicznych halogenków..
Poniższy obraz przedstawia gazowe cząsteczki halogenów. Od góry do dołu: fluor (F.dwa), chlor (Cldwa), brom (Brdwa) i jod (Idwa). Każdy z nich ma zdolność reagowania z ogromną większością pierwiastków, nawet pomiędzy kongenerami tej samej grupy (interhalogeny).
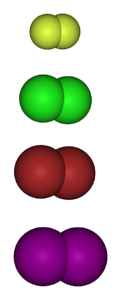
Zatem pochodne chlorowcowane mają wzór MX, jeśli jest halogenkiem metalu, RX, jeśli jest alkilem i ArX, jeśli jest aromatyczny. Ostatnie dwa należą do kategorii halogenków organicznych. Stabilność tych związków wymaga „korzyści” energetycznej w porównaniu z pierwotną cząsteczką gazu.
Z reguły fluor tworzy bardziej stabilne pochodne chlorowcowane niż jod. Powodem są różnice między ich promieniami atomowymi (fioletowe kule są bardziej obszerne niż żółte).
Wraz ze wzrostem promienia atomowego nakładanie się orbitali między halogenem a drugim atomem jest gorsze, a zatem wiązanie jest słabsze..
Indeks artykułów
- 1 Nazewnictwo
- 1.1 Nieorganiczne
- 1.2 Organiczne
- 2 Właściwości
- 2.1 Nieorganiczne halogenki
- 2.2 Halogenki organiczne
- 3 Zastosowania
- 4 Dodatkowe przykłady
- 5 Referencje
Nomenklatura
Prawidłowy sposób nazwania tych związków zależy od tego, czy są one nieorganiczne, czy organiczne..
Nieorganiczny
Halogenki metali składają się z wiązania jonowego lub kowalencyjnego między halogenem X i metalem M (z grupy 1 i 2, metale przejściowe, metale ciężkie itp.).
W tych związkach wszystkie halogeny mają stopień utlenienia -1. Dlaczego? Ponieważ jego ustawienia wartościowości są nsdwanp5.
Dlatego potrzebują tylko jednego elektronu, aby uzupełnić oktet walencyjny, podczas gdy metale utleniają się, dając im dostępne elektrony..
Zatem fluor pozostaje jako F-, fluorek; Cl-, chlorek; BR-, bromek; i I-, Ja ostatni. MF byłoby nazwane: (nazwa metalu) fluorek (n), gdzie n jest wartościowością metalu tylko wtedy, gdy ma więcej niż jeden. W przypadku metali z grup 1 i 2 nie jest konieczne nazywanie wartościowości.
Przykłady
- NaF: fluorek sodu.
- CaCldwa: chlorek wapnia.
- AgBr: bromek srebra.
- ZnIdwa: jodek cynku.
- CuCl: chlorek miedzi (I).
- CuCldwa: chlorek miedzi (II).
- TiCl4: chlorek tytanu (IV) lub czterochlorek tytanu.
Jednak wodór i pierwiastki niemetalowe - nawet same halogeny - mogą również tworzyć halogenki. W takich przypadkach wartościowość niemetalu nie jest na końcu nazwana:
- PCl5: pentachlorek fosforu.
- BF3: trifluorek boru.
- Ali3: trójjodek glinu.
- HBr: bromowodór.
- GDYBY7: heptafluorek jodu.
Organiczny
Niezależnie od tego, czy jest to RX czy ArX, halogen jest kowalencyjnie związany z atomem węgla. W takich przypadkach halogeny są wymieniane przez ich nazwy, a reszta nazewnictwa zależy od struktury cząsteczkowej R lub Ar.
Najprostszą cząsteczką organiczną jest metan (CH4), następujące pochodne otrzymuje się przez podstawienie H zamiast Cl:
- CH3Cl: chlorometan.
- CHdwaCldwa: dichlorometan.
- CHCl3: trichlorometan (chloroform).
- CCl4: tetrachlorometan (chlorek węgla (IV) lub tetrachlorek węgla).
Tutaj R składa się z pojedynczego atomu węgla. Zatem dla innych łańcuchów alifatycznych (liniowych lub rozgałęzionych) liczy się liczbę atomów węgla, z których jest połączony z halogenem:
CH3CHdwaCHdwaF: 1-fluoropropan.
Powyższy przykład dotyczy pierwszorzędowego halogenku alkilu. W przypadku rozgałęzienia łańcucha wybiera się najdłuższy łańcuch zawierający halogen i rozpoczyna się liczenie, pozostawiając możliwie najmniejszą liczbę:
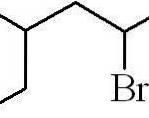
3-metylo-5-bromoheksan
To samo dzieje się z innymi podstawnikami. Podobnie w przypadku halogenków aromatycznych nazywa się halogen, a następnie resztę struktury:
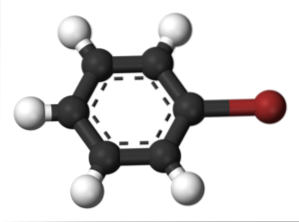
Górny obraz przedstawia związek zwany bromobenzenem, zaznaczając atom bromu na brązowo.
Nieruchomości
Nieorganiczne halogenki
Nieorganiczne halogenki są jonowymi lub cząsteczkowymi ciałami stałymi, chociaż te pierwsze są bardziej powszechne. W zależności od oddziaływań i promieni jonowych MX będzie rozpuszczalny w wodzie lub innych mniej polarnych rozpuszczalnikach.
Halogenki niemetaliczne (takie jak halogenki boru) są na ogół kwasami Lewisa, co oznacza, że przyjmują elektrony do tworzenia kompleksów. Z drugiej strony halogenki wodoru (lub halogenki) rozpuszczone w wodzie wytwarzają tak zwane węglowodory..
Jego punkty topnienia, wrzenia lub sublimacji zależą od elektrostatycznych lub kowalencyjnych oddziaływań między metalem lub niemetalem z halogenem..
Podobnie, promienie jonowe odgrywają ważną rolę w tych właściwościach. Na przykład, jeśli M.+ i X- mają podobne rozmiary, twoje kryształy będą bardziej stabilne.
Halogenki organiczne
Są polarne. Dlaczego? Ponieważ różnica w elektroujemności między C i halogenem tworzy trwały moment polarny w cząsteczce. Podobnie zmniejsza się, gdy grupa 17 schodzi, od wiązania C-F do C-I.
Niezależnie od struktury cząsteczkowej R lub Ar, rosnąca liczba halogenów wpływa bezpośrednio na temperaturę wrzenia, ponieważ zwiększa masę molową i interakcje międzycząsteczkowe (RC-X-X-CR). Większość nie miesza się z wodą, ale może rozpuszczać się w rozpuszczalnikach organicznych.
Aplikacje
Zastosowania pochodnych chlorowcowanych mogą być opatrzone własnym tekstem. Molekularni „partnerzy” halogenów są kluczowym czynnikiem, ponieważ ich właściwości i reaktywność określają zastosowania pochodnej..
Dlatego wśród ogromnej różnorodności możliwych zastosowań wyróżniają się następujące:
- Halogeny molekularne są używane do tworzenia żarówek halogenowych, w których stykają się z żarzącym się włóknem wolframowym. Celem tej mieszaniny jest przereagowanie halogenu X z odparowanym wolframem. W ten sposób unika się jego osadzania na powierzchni bańki, co gwarantuje dłuższą żywotność..
- Sole fluorkowe są używane do fluoryzacji wody i past do zębów.
- Podchloryny sodu i wapnia są dwoma substancjami czynnymi w komercyjnych roztworach wybielających (chlor)..
- Chociaż chlorofluorowęglowodory (CFC) uszkadzają warstwę ozonową, są stosowane w aerozolach i systemach chłodniczych..
- Chlorek winylu (CHdwa= CHCl) jest monomerem polimeru polichlorku winylu (PVC). Z drugiej strony teflon, używany jako materiał zapobiegający przywieraniu, składa się z łańcuchów polimerowych tetrafluoroetylenu (FdwaC = CFdwa).
- Są wykorzystywane w chemii analitycznej oraz w syntezach organicznych do różnych celów; wśród nich synteza leków.
Dodatkowe przykłady
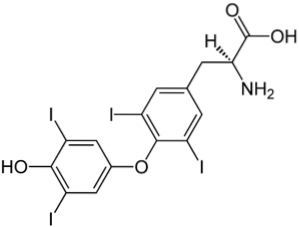
Górny obraz przedstawia hormon tarczycy odpowiedzialny za produkcję ciepła oraz wzrost ogólnego metabolizmu organizmu. Związek ten jest przykładem chlorowcowanej pochodnej występującej w organizmie człowieka.
Wśród innych związków chlorowcowanych wymienia się:
- Dichlorodifenylotrichloroetan (DDT), skuteczny środek owadobójczy, ale mający poważny wpływ na środowisko.
- Chlorek cyny (SnCldwa), stosowany jako środek redukujący.
- Chloroetan lub 1-chloroetan (CH3CHdwaCl), miejscowy środek znieczulający, który szybko działa chłodząc skórę.
- Dichloroetylen (ClCH = CClH) i tetrachloroetylen (CldwaC = CCldwa), stosowane jako rozpuszczalniki w przemyśle chemicznym.
Bibliografia
- Dr Ian Hunt. Podstawowa nomenklatura organiczna IUPAC Haloalkany / halogenki alkilowe. Pobrane 4 maja 2018 z: chem.ucalgary.ca
- Richard C. Banks. (Sierpień 2000). Nazewnictwo halogenków organicznych. Pobrane 4 maja 2018 z: chemistry.boisestate.edu
- Advameg, Inc. (2018). Organiczne związki halogenowe. Pobrane 4 maja 2018 r. Z: chemistryexplained.com
- Organiczne związki halogenowe. Pobrane 4 maja 2018 r. Z: 4college.co.uk
- Dr Seham Alterary. (2014). Organiczne związki halogenowe. Pobrane 4 maja 2018 r. Z: fac.ksu.edu.sa
- Clark J. Fizyczne właściwości halogenków alkilowych. Pobrane 4 maja 2018 r. Z: chem.libretexts.org
- Dr Manal K. Rasheed. Halogenki organiczne. Pobrane 4 maja 2018 r. Z: comed.uobaghdad.edu.iq

Jeszcze bez komentarzy