
Ciepło

Co to jest utajone ciepło?
Ciepło utajone to ilość ciepła, którą substancja musi wchłonąć lub uwolnić, aby zmienić swój stan fizyczny lub fazę, utrzymując stałą temperaturę podczas tego procesu. Dostarczone lub uwolnione ciepło nie objawia się, nie jest „odczuwane”, jak to zwykle bywa w przypadku zmian temperatury; stąd określenie utajone ciepło.
Ukryte słowo pochodzi od łacińskiego słowa „latens”, co oznacza ukryte, więc utajone ciepło zachowuje się tak, jakby nie istniało, gdy temperatura była utrzymywana na stałym poziomie. Ale istnieje: dzieje się tak, że jest całkowicie zużyty podczas zmiany fazy lub stanu fizycznego.
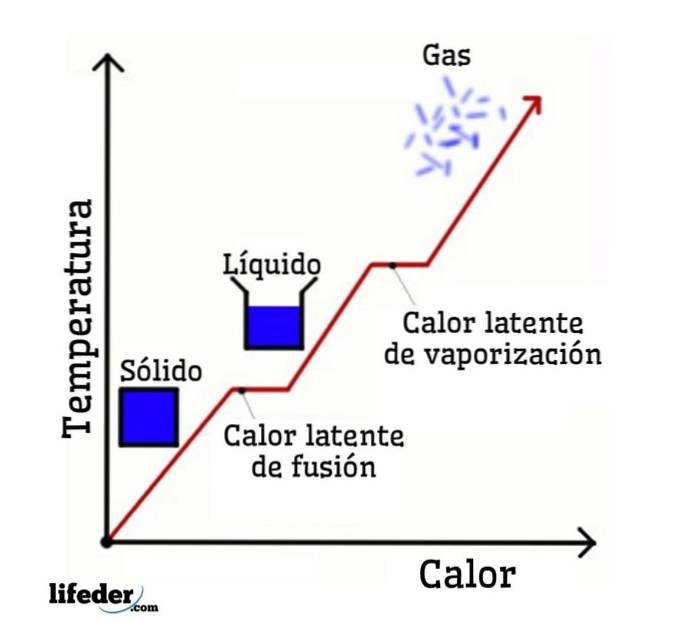
Na przykładzie wody zmiany fazowe są następujące: lód (ciało stałe) topi się w ciekłą wodę (ciecz) w procesie zwanym topieniem; a ciekła woda z kolei paruje, przekształcając się w parę wodną (gaz) w procesie zwanym parowaniem.
Z drugiej strony para wodna jest schładzana do ciekłej wody w procesie zwanym kondensacją; a woda w stanie ciekłym zamienia się z powrotem w lód w procesie zwanym krzepnięciem.
Każda z tych zmian fazowych jest związana z ciepłem utajonym, które może być dodatnie (absorpcja) lub ujemne (uwolnienie)..
Utajone ciepło topnienia

Jest to ilość ciepła, jaką należy dostarczyć do określonej ilości substancji stałej, aby zmienić jej stan skupienia ze stałego na ciekły. Podczas stapiania nie ma zmiany temperatury, więc gdy ciało stałe topi się lub topi, ciecz, która jest z niego wytwarzana, ma taką samą temperaturę jak cała substancja stała.
Ogólnie ciepło to jest określane w normalnej temperaturze topnienia, która jest temperaturą, w której ciało stałe zaczyna się topić pod ciśnieniem atmosferycznym. W tej temperaturze występuje równowaga lub jednoczesna obecność stanu stałego i stanu ciekłego w tym samym czasie..
Stan stały charakteryzuje się obecnością zwartej struktury ze względu na istnienie wysokoenergetycznych wiązań chemicznych, które nadają mu sztywność strukturalną. Aby przekształcić ciało stałe w ciecz, interakcje te muszą zostać przerwane, więc energia jest zużywana (pochłaniana) do tego celu.
Typowym przykładem jest spożywanie lodów, które składają się z wody, cukru i innych substancji. Często obserwuje się, że lody, jeśli nie zostaną szybko zjedzone, zaczynają się topić, czyli topić. Dzieje się tak, gdy temperatura lodów osiąga temperaturę topnienia lodu..
Przykłady
Wymienione zostaną niektóre przykłady utajonych cieple topnienia wyrażone w J / g; to znaczy energia, którą musi zaabsorbować gram ciała stałego, aby stopić się w temperaturze topnienia:
-Lód 334,0
-Aluminium 380,0
-Siarka 38,1
-Miedź 134,0
-Etanol 104,0
-Rtęć 11.8
-Złoto 64,5
-Srebro 80.3
-Ołów 24,5
-Wolfram 184
Lód pochłania dużo ciepła nie dlatego, że jego interakcje są silniejsze, ale dlatego, że jest w stanie wyjątkowo rozpraszać ciepło między kryształami..
Utajone ciepło parowania
Jest to ilość ciepła, jaką dana ilość substancji pochłania, aby przejść ze stanu ciekłego do stanu gazowego w normalnej temperaturze wrzenia. Oznacza to, że jest to ciepło, które ciecz pochłania podczas gotowania i zamienia się w gaz bez wzrostu temperatury..
W cieczy cząsteczki substancji mogą oddziaływać na siebie poprzez tworzenie wiązań wodorowych i siły przyciągania między cząsteczkami. Aby przejść substancję ze stanu ciekłego do stanu gazowego, siły te muszą zostać pokonane, więc należy dostarczyć ciepło.
Ciepło jawne jest tym, co ciecz pochłania tylko w celu podwyższenia temperatury, która będzie zależała od jego ciepła właściwego. Tymczasem utajone ciepło parowania jest wykorzystywane do przekształcenia go bezpośrednio w parę, co jest znacznie łatwiejsze w temperaturze wrzenia..
Przykłady
Poniżej wymienione są przykłady niektórych cieczy wraz z ich odpowiednimi utajonymi ciepłami parowania wyrażonymi ponownie w J / g:
-Kwas octowy 402
-Biedronka 518
-Wiśniewska 2256
-Alkohol etylowy 846
-Siarka 1510
-Wiśniewska 390
-Dwutlenek węgla 574
-Chlor 293
-Wiśniewska 377
-Gliwice 974
-Rycerski 295
-Tlen 214
Zwróć uwagę na ogromne utajone ciepło wody w stanie ciekłym: 1 g wody w stanie ciekłym (około 1 ml) musi wchłonąć 2256 J, aby odparować. Ciekła woda rozprasza otrzymane ciepło jeszcze lepiej w porównaniu z lodem.
Utajone ciepło krzepnięcia
Jest to ciepło, które musi wydzielać pewna ilość substancji, aby przejść ze stanu ciekłego do stanu stałego w momencie krzepnięcia lub zamarzania. Ponownie, dopóki ciecz nie zestali się całkowicie, temperatura pozostanie stała..
Proces krzepnięcia jest odwrotnością procesu fuzji, więc wartości utajonego ciepła krzepnięcia i ciepła utajonego topnienia są takie same, ale z przeciwnymi znakami..
Cząsteczki substancji w stanie ciekłym poruszają się z pewną swobodą dzięki posiadanej energii. Dlatego, aby przejść do fazy stałej, cząsteczki muszą uwolnić energię w postaci ciepła, co pozwala na większą interakcję między cząsteczkami substancji..
Interakcja między cząsteczkami sprzyja tworzeniu się wiązań chemicznych w fazie stałej. Przykładem tego jest umieszczenie wody w stanie ciekłym w pojemnikach do wytwarzania lodu w chłodziarko-zamrażarce. Zamrażarka pobiera ciepło z wody w stanie ciekłym i krzepnie, zamieniając się w lód.
Przykłady
Poniżej wymieniono kilka przykładów utajonego ciepła krzepnięcia (w J / g) dla niektórych cieczy:
-Woda (-334)
-Aluminium (-380)
-Siarka (-38)
-Miedź (-134)
-Etanol (-104)
Utajone ciepło kondensacji
Jest to ilość ciepła, które musi zostać oddane lub uwolnione z określonej ilości substancji, aby przejść ze stanu gazowego do stanu ciekłego. Skraplający się gaz i utworzona ciecz utrzymują tę samą temperaturę podczas kondensacji.
Kondensacja jest przeciwieństwem parowania. Utajone ciepło kondensacji ma taką samą wartość jak utajone ciepło parowania, ale z przeciwnym znakiem i w temperaturze wrzenia. Przykładem tego jest gotowanie i kondensacja pary we wnętrzu garnków..
Cząsteczki gazowe poruszają się swobodnie, napędzane posiadaną energią. Dlatego muszą uwolnić energię, aby umożliwić międzycząsteczkowym interakcjom stanu ciekłego ustanowienie między cząsteczkami substancji..
W przyrodzie jest wiele innych przykładów zjawiska kondensacji wody. Para wodna unosi się w atmosferze i skrapla się w chmurach w postaci kropelek wody.
Obserwuje się również występowanie kropelek wody w szybach samochodowych, na skutek kondensacji wody na skutek spadku temperatury występującego wczesnym rankiem, stanowiącej tzw..
Przykłady
Na koniec, dla niektórych par zostaną wymienione ich odpowiednie utajone ciepło kondensacji wyrażone ponownie w J / g:
-Kwas octowy (-402)
-Aceton (-518)
-Woda (-2256)
-Alkohol etylowy (-846)
-Siarka (-1510)
-Benzen (-390)
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Wydanie czwarte, Longmans.
- Wikipedia. (2020). Ciepło. Odzyskane z: en.wikipedia.org
- Redaktorzy Encyclopaedia Britannica. (2020). Ciepło. Odzyskany z: britannica.com
- Engineering ToolBox. (2003). Płyny: utajone ciepło parowania. Odzyskany z: engineeringtoolbox.com
- Lumen Learning. (s.f.). Zmiana fazy i ciepło utajone. Odzyskany z: course.lumenlearning.com



Jeszcze bez komentarzy