
Charakterystyka reakcji neutralizacji, produkty, przykłady

ZA Reakcja neutralizacji To ten, który występuje między kwasem a gatunkiem zasadowym w sposób ilościowy. Na ogół w tego typu reakcji w środowisku wodnym woda i sól (związki jonowe składające się z kationu innego niż H+ i anion inny niż OH- lub Odwa-) zgodnie z następującym równaniem: kwas + zasada → sól + woda.
Na reakcję neutralizacji mają wpływ elektrolity, czyli te substancje, które po rozpuszczeniu w wodzie wytwarzają roztwór umożliwiający przewodnictwo elektryczne. Kwasy, zasady i sole są uważane za elektrolity.

W ten sposób silne elektrolity to te gatunki, które całkowicie dysocjują na jony składowe, gdy są w roztworze, podczas gdy słabe elektrolity są tylko częściowo zjonizowane (mają mniejszą zdolność przewodzenia prądu elektrycznego; to znaczy nie są dobrymi przewodnikami, jak mocne elektrolity).
Indeks artykułów
- 1 Funkcje
- 1.1 Miareczkowanie kwasowo-zasadowe
- 2 Przykłady
- 2.1 Mocny kwas + mocna zasada
- 2.2 Mocny kwas + słaba zasada
- 2.3 Słaby kwas + mocna zasada
- 2.4 Słaby kwas + słaba zasada
- 3 Odnośniki
Charakterystyka
Przede wszystkim należy podkreślić, że jeśli reakcję zobojętniania rozpoczyna się od równych ilości kwasu i zasady (w molach), po zakończeniu tej reakcji otrzymuje się tylko jedną sól; tj. nie ma resztkowych ilości kwasu lub zasady.
Bardzo ważną właściwością reakcji kwasowo-zasadowych jest również pH, które wskazuje, jak kwaśny lub zasadowy jest roztwór. Decyduje o tym ilość jonów H.+ znalezione w mierzonych roztworach.
Z drugiej strony istnieje kilka koncepcji kwasowości i zasadowości w zależności od branych pod uwagę parametrów. Jedną z wyróżniających się koncepcji jest koncepcja Brønsteda i Lowry'ego, którzy uważają kwas za gatunek zdolny do przekazywania protonów (H+) i podstawowy gatunek zdolny do ich akceptacji.
Miareczkowanie kwasowo-zasadowe
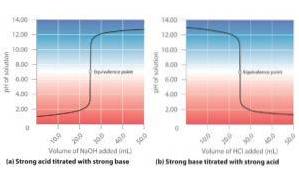
Aby prawidłowo i ilościowo zbadać reakcję neutralizacji między kwasem a zasadą, stosuje się technikę zwaną miareczkowaniem kwasowo-zasadowym (lub miareczkowaniem)..
Miareczkowanie kwasowo-zasadowe polega na określeniu stężenia kwasu lub zasady niezbędnego do zneutralizowania określonej ilości zasady lub kwasu o znanym stężeniu.
W praktyce roztwór wzorcowy (którego stężenie jest dokładnie znane) musi być stopniowo dodawany do roztworu, którego stężenie jest nieznane, aż do osiągnięcia punktu równoważności, w którym jeden z gatunków całkowicie zneutralizuje drugi..
Punkt równoważnikowy jest wykrywany przez gwałtowną zmianę koloru wskaźnika, który został dodany do roztworu o nieznanym stężeniu, gdy reakcja chemiczna między oboma roztworami została zakończona..
Na przykład w przypadku neutralizacji kwasu fosforowego (H.3PO4) będzie punkt równoważnikowy dla każdego protonu uwolnionego z kwasu; to znaczy, że będą trzy punkty równoważności i zostaną zaobserwowane trzy zmiany koloru.
Produkty reakcji neutralizacji
W reakcjach mocnego kwasu z mocną zasadą następuje całkowite zobojętnienie gatunku, podobnie jak w reakcji między kwasem solnym i wodorotlenkiem baru:
2HCl (aq) + Ba (OH)dwa(ac) → BaCldwa(aq) + 2HdwaO (l)
Zatem jony H. nie są generowane+ u OH- w nadmiarze, co oznacza, że pH zneutralizowanych roztworów silnych elektrolitów jest nieodłącznie związane z kwasowym charakterem ich reagentów.
Z drugiej strony, w przypadku neutralizacji między słabym a mocnym elektrolitem (mocny kwas + słaba zasada lub słaby kwas + mocna zasada) uzyskuje się częściową dysocjację słabego elektrolitu i stałą dysocjacji kwasu (Kdo) lub podstawa (K.b) słaby, w celu określenia kwaśnego lub zasadowego charakteru reakcji netto poprzez obliczenie pH.
Na przykład mamy reakcję między kwasem cyjanowodorowym a wodorotlenkiem sodu:
HCN (aq) + NaOH (aq) → NaCN (aq) + HdwaO (l)
W tej reakcji słaby elektrolit nie jonizuje zauważalnie w roztworze, więc równanie jonowe netto jest przedstawione w następujący sposób:
HCN (aq) + OH-(ac) → CN-(ac) + HdwaO (l)
Uzyskuje się to po zapisaniu reakcji z silnymi elektrolitami w ich zdysocjowanej formie (Na+(ac) + OH-(ac) po stronie reagenta i Na+(ac) + CN-(ac) po stronie produktu), gdzie tylko jon sodu jest osobą postronną.
Wreszcie, w przypadku reakcji między słabym kwasem a słabą zasadą, zobojętnianie nie zachodzi. Dzieje się tak, ponieważ oba elektrolity częściowo dysocjują, nie powodując oczekiwanej wody i soli..
Przykłady
Mocny kwas + mocna zasada
Podana reakcja między kwasem siarkowym i wodorotlenkiem potasu w środowisku wodnym jest traktowana jako przykład, zgodnie z następującym równaniem:
H.dwapołudniowy zachód4(aq) + 2KOH (aq) → Kdwapołudniowy zachód4(aq) + 2HdwaO (l)
Można zauważyć, że zarówno kwas, jak i wodorotlenek są silnymi elektrolitami; dlatego całkowicie jonizują w roztworze. Wartość pH tego roztworu będzie zależała od silnego elektrolitu, który ma największą proporcję.
Mocny kwas + słaba zasada
W wyniku neutralizacji kwasu azotowego amoniakiem powstaje azotan amonu, jak pokazano poniżej:
HNO3(ac) + NH3(ac) → NH4NIE3(ac)
W tym przypadku woda wytwarzana razem z solą nie jest obserwowana, ponieważ musiałaby być przedstawiona jako:
HNO3(ac) + NH4+(ac) + OH-(ac) → NH4NIE3(ac) + HdwaO (l)
Zatem wodę można postrzegać jako produkt reakcji. W takim przypadku roztwór będzie miał zasadniczo kwaśne pH.
Słaby kwas + mocna zasada
Reakcja zachodząca między kwasem octowym a wodorotlenkiem sodu jest pokazana poniżej:
CH3COOH (aq) + NaOH (aq) → CH3COONa (ac) + H.dwaO (l)
Ponieważ kwas octowy jest słabym elektrolitem, częściowo dysocjuje, w wyniku czego powstaje octan sodu i woda, których roztwór będzie miał zasadowe pH..
Słaby kwas + słaba zasada
Wreszcie, jak wspomniano wcześniej, słaba zasada nie może zneutralizować słabego kwasu; nie dzieje się też odwrotnie. Oba rodzaje są hydrolizowane w roztworze wodnym, a pH roztworu będzie zależało od „mocy” kwasu i zasady..
Bibliografia
- Wikipedia. (s.f.). Neutralizacja (chemia). Odzyskany z en.wikipedia.org
- Chang, R. (2007). Chemia, wydanie dziewiąte (McGraw-Hill).
- Raymond, K. W. (2009). Ogólna chemia organiczna i biologiczna. Odzyskany z books.google.co.ve
- Joesten, M. D., Hogg, J. L. and Castellion, M. E. (2006). Świat chemii: podstawy. Odzyskany z books.google.co.ve
- Clugston, M. i Flemming, R. (2000). Zaawansowana chemia. Odzyskany z books.google.co.ve
- Reger, D. L., Goode, S. R. and Ball, D. W. (2009). Chemia: zasady i praktyka. Odzyskany z books.google.co.ve



Jeszcze bez komentarzy