
Pojęcie wrażliwe na ciepło, formuły i rozwiązane ćwiczenia
Plik ciepło jawne to energia cieplna dostarczana do obiektu powodująca wzrost jego temperatury. Jest przeciwieństwem ciepła utajonego, w którym energia cieplna nie podnosi temperatury, ale raczej sprzyja przemianie fazowej, na przykład ze stanu stałego w ciekły..
Przykład wyjaśnia koncepcję. Załóżmy, że mamy garnek z wodą o temperaturze pokojowej 20 ° C. Gdy postawimy go na piecu, dostarczone ciepło powoli podnosi temperaturę wody aż do osiągnięcia 100 ° C (temperatura wrzenia wody na poziomie morza). Dostarczone ciepło nazywane jest ciepłem jawnym.

Gdy woda osiągnie punkt wrzenia, ciepło dostarczane przez palnik nie podnosi już temperatury wody, która utrzymuje się na poziomie 100 ° C. W tym przypadku dostarczona energia cieplna jest inwestowana w odparowywanie wody. Dostarczone ciepło jest utajone, ponieważ nie podniosło temperatury, a zamiast tego spowodowało przejście z fazy ciekłej do fazy gazowej.
Jest faktem doświadczalnym, że jawne ciepło niezbędne do osiągnięcia określonej zmiany temperatury jest wprost proporcjonalne do tej zmiany i do masy obiektu..
Indeks artykułów
- 1 Pojęcie i formuły
- 1.1 Współczynnik adiabatyczny γ
- 1.2 Pojemność cieplna C.
- 1.3 Ciepło właściwe w ciałach stałych, cieczach i gazach
- 2 Różnica z ciepłem utajonym
- 2.1 Jak obliczyć ciepło utajone?
- 3 ćwiczenia rozwiązane
- 3.1 Przykład 1
- 3.2 Przykład 2
- 3.3 Przykład 3
- 4 Odnośniki
Pojęcie i formuły
Zaobserwowano, że oprócz masy i różnicy temperatur, ciepło jawne zależy również od materiału. Z tego powodu stała proporcjonalności między ciepłem jawnym a iloczynem masy i różnicy temperatur nazywana jest ciepłem właściwym.
Ilość dostarczanego ciepła jawnego zależy również od sposobu prowadzenia procesu. Na przykład inaczej jest, jeśli proces jest prowadzony przy stałej objętości niż przy stałym ciśnieniu.
Receptura na ciepło jawne w procesie izobaryczny, to znaczy przy stałym ciśnieniu wygląda to tak:
Q = cp . m (T.fa - Tja)
W powyższym równaniu Q jest ciepłem jawnym dostarczanym do obiektu masowego m, który podniósł jego początkową temperaturę Tja do ostatecznej wartości Tf. W powyższym równaniu również się pojawia dop, czyli ciepło właściwe materiału przy stałym ciśnieniu, ponieważ proces został przeprowadzony w ten sposób.
Należy również zauważyć, że ciepło jawne jest dodatnie, gdy jest pochłaniane przez obiekt i powoduje wzrost temperatury..
W przypadku, gdy ciepło jest dostarczane do gazu zamkniętego w sztywnym pojemniku, proces będzie izochoryczny, to znaczy przy stałej głośności; a wzór na ciepło jawne zostanie napisany w ten sposób:
Q = cv. m. (Tfa - Tja)
Współczynnik adiabatyczny γ
Iloraz między ciepłem właściwym przy stałym ciśnieniu a ciepłem właściwym przy stałej objętości dla tego samego materiału lub substancji jest nazywany współczynnik adiabatyczny, co jest zwykle oznaczane grecką literą gamma γ.
Plik współczynnik adiabatyczny jest większa niż jedność. Ciepło potrzebne do podniesienia temperatury ciała o masie jednego grama o jeden stopień jest większe w procesie izobarycznym niż w procesie izochorycznym..
Dzieje się tak, ponieważ w pierwszym przypadku część ciepła jest wykorzystywana do wykonywania prac mechanicznych.
Oprócz ciepła właściwego często określa się również pojemność cieplną ciała. Jest to ilość ciepła potrzebna do podniesienia temperatury ciała o jeden stopień Celsjusza.
Pojemność cieplna C.
Pojemność cieplna jest oznaczona przez do duża litera, a ciepło właściwe z do małe litery. Zależność między obiema wielkościami jest następująca:
C = c⋅ m
Gdzie m to masa ciała.
Stosuje się również ciepło właściwe, które definiuje się jako ilość ciepła jawnego potrzebną do podniesienia temperatury jednego mola substancji o jeden stopień Celsjusza lub Kelvina..
Ciepło właściwe w ciałach stałych, cieczach i gazach
Molowe ciepło właściwe większości ciał stałych ma wartość bliską 3 czasy R, gdzie R jest uniwersalną stałą gazową. R = 8,314472 J / (mol ℃).
Na przykład aluminium ma molowe ciepło właściwe 24,2 J / (mol ℃), Miedź 24,5 J / (mol ℃), złoto 25,4 J / (mol ℃), i słodkie żelazo 25,1 J / (mol ℃). Zwróć uwagę, że te wartości są bliskie 3R = 24,9 J / (mol ℃).
W przeciwieństwie do większości gazów, ciepło właściwe jest bliskie n (R / 2), gdzie jest n liczba całkowita i R jest uniwersalną stałą gazową. Cała liczba n jest związana z liczbą stopni swobody cząsteczki tworzącej gaz.
Na przykład w jednoatomowym gazie idealnym, którego cząsteczka ma tylko trzy translacyjne stopnie swobody, ciepło właściwe molowe przy stałej objętości wynosi 3 (R / 2). Ale jeśli jest to dwuatomowy gaz doskonały, to są dodatkowo dwa stopnie rotacji, tzw dov = 5 (R / 2).
W gazach doskonałych zachodzi następująca zależność między molowym ciepłem właściwym przy stałym ciśnieniu a stałą objętością: dop = cv + R.
Na szczególne wyróżnienie zasługuje woda. W stanie ciekłym w temperaturze 25 ℃ ma wodę dop = 4,1813 J / (g ℃), para wodna przy 100 stopniach Celsjusza ma dop = 2080 J / (g ℃) i lodowata woda o temperaturze zero stopni Celsjusza dop = 2050 J / (g ℃).
Różnica z ciepłem utajonym
Materia może znajdować się w trzech stanach: stałym, ciekłym i gazowym. Do zmiany stanu potrzebna jest energia, ale każda substancja reaguje na nią w inny sposób, zgodnie z jej właściwościami molekularnymi i atomowymi..
Kiedy ciało stałe topi się lub ciecz paruje, temperatura obiektu pozostaje stała, dopóki wszystkie cząstki nie zmienią swojego stanu..
Z tego powodu możliwe jest, aby substancja znajdowała się w równowadze w dwóch fazach, na przykład: stała - ciecz lub ciecz - para. Pewna ilość substancji może przejść z jednego stanu do drugiego przez dodanie lub usunięcie niewielkiej ilości ciepła, podczas gdy temperatura pozostaje stała..
Ciepło dostarczane do materiału powoduje, że jego cząstki szybciej drgają i zwiększają ich energię kinetyczną. Przekłada się to na wzrost temperatury.
Możliwe, że energia, którą zdobywają, jest tak duża, że nie wracają już do swojej pozycji równowagi, a separacja między nimi wzrasta. Kiedy tak się dzieje, temperatura nie rośnie, ale substancja przechodzi ze stanu stałego w ciecz lub z cieczy w gaz.
Ciepło potrzebne do tego jest znane jako Ciepło. Dlatego ciepło utajone to ciepło, pod wpływem którego substancja może zmienić fazę.
Oto różnica z ciepłem jawnym. Substancja, która pochłania ciepło jawne, podnosi swoją temperaturę i pozostaje w tym samym stanie.
Jak obliczyć ciepło utajone?
Ciepło utajone oblicza się według równania:
Q = m. L
Gdzie L może to być ciepło właściwe parowania lub ciepło topnienia. Jednostki L to energia / masa.
Naukowcy nadali ciepłu wiele nazw, w zależności od rodzaju reakcji, w której uczestniczy. Na przykład istnieje ciepło reakcji, ciepło spalania, ciepło krzepnięcia, ciepło roztworu, ciepło sublimacji i wiele innych..
Wartości wielu z tych rodzajów ciepła dla różnych substancji są zestawione w tabeli.
Rozwiązane ćwiczenia
Przykład 1
Załóżmy, że ma kawałek aluminium o masie 3 kg. Początkowo jest to 20 ° C i chcesz podnieść jego temperaturę do 100 ° C. Oblicz wymagane ciepło jawne.
Rozwiązanie
Najpierw musimy poznać ciepło właściwe aluminium
dop = 0,897 J / (g ° C)
Wtedy będzie ilość ciepła potrzebna do ogrzania kawałka aluminium
Q = cp m (Tf - Ti) = 0,897 * 3000 * (100 - 20) J
Q = 215 280 J.
Przykład 2
Oblicz ilość ciepła potrzebną do podgrzania 1 litra wody z 25 ° C do 100 ° C na poziomie morza. Wyraź wynik również w kilokaloriach.
Rozwiązanie
Pierwszą rzeczą do zapamiętania jest to, że 1 litr wody waży 1 kg, czyli 1000 gramów.
Q = cp m (Tf - Ti) = 4,1813 J / (g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
Kaloria to jednostka energii definiowana jako ciepło jawne niezbędne do podniesienia grama wody o jeden stopień Celsjusza. Dlatego 1 kaloria równa się 4,1813 dżuli.
Q = 313597,5 J * (1 kal. / 4,1813 J) = 75000 kal. = 75 kcal.
Przykład 3
360,16 gramowy kawałek materiału jest podgrzewany od 37 ℃ do 140 ℃. Dostarczona energia cieplna to 1150 kalorii.
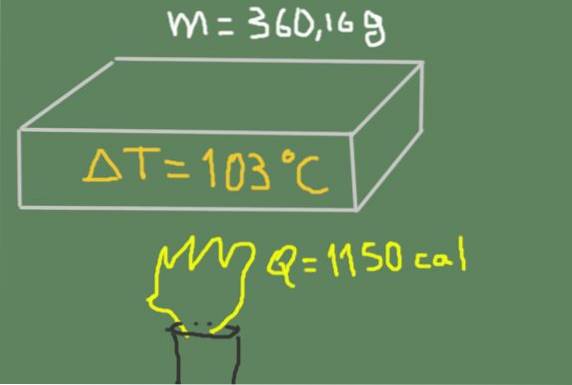
Znajdź ciepło właściwe materiału.
Rozwiązanie
Ciepło właściwe możemy zapisać jako funkcję ciepła jawnego, masy i zmiany temperatury zgodnie ze wzorem:
dop = Q / (m ΔT)
Zastępując dane mamy:
dop = 1150 cal / (360,16 g * (140 ℃ - 37 ℃)) = 0,0310 cal / (g ℃)
Ale ponieważ jedna kaloria równa się 4,1813 J, wynik można również wyrazić jako
dop = 0,130 J / (g ℃)
Bibliografia
- Giancoli, D. 2006. Fizyka: Zasady z zastosowaniami. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fizyka: spojrzenie na świat. 6ta Wydanie skrócone. Cengage Learning. 156-164.
- Tippens, P. 2011. Fizyka: koncepcje i zastosowania. 7. Wydanie poprawione. McGraw Hill. 350 - 368.
- Rex, A. 2011. Podstawy fizyki. Osoba. 309 - 332.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z fizyką współczesną. 14th. Tom 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Podstawy fizyki. 9na Cengage Learning. 362 - 374.



Jeszcze bez komentarzy