
Historia, właściwości, budowa, pozyskiwanie, zastosowania fosforu
Plik mecz Jest to pierwiastek niemetaliczny, który jest reprezentowany przez symbol chemiczny P i ma liczbę atomową 15. Posiada trzy główne formy alotropowe: fosfor biały, czerwony i czarny. Biały fosfor jest fosforyzujący, spala się samorzutnie pod wpływem powietrza i jest również silnie trujący..
Fosfor biały w temperaturze 250 ° C zmienia się w fosfor czerwony; nierozpuszczalna, polimerowa forma, która nie pali się w powietrzu. W wysokich temperaturach i ciśnieniach, a także w obecności lub bez katalizatorów, uzyskuje się fosfor czarny, który przypomina grafit i jest dobrym przewodnikiem prądu elektrycznego..

Fosfor został po raz pierwszy wyizolowany przez H. Branda w 1669 roku. Źródłem tego pierwiastka był dla niego mocz. W 1770 r. W. Scheele odkrył, że może również izolować fosfor z kości.
Później, dzięki stworzeniu przez J. Burgessa Readmana (1800) pieca elektrycznego, skały fosforanowe stały się głównym źródłem produkcji fosforu z występującego w nich minerału fluoroapatytu..
Fosfor jest dwunastym najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej, stanowiąc 0,1% jego wagi. Ponadto jest to szósty element w obfitości w ludzkim ciele; skoncentrowany głównie w kościach w postaci hydroksyloapatytu.
Jest zatem niezbędnym pierwiastkiem dla istot żywych, stając się jednym z trzech głównych składników odżywczych roślin. Fosfor jest częścią struktury chemicznej kwasów nukleinowych; związków magazynujących energię (ATP), koenzymów; i ogólnie, związków metabolizmu.
Indeks artykułów
- 1 Historia
- 1.1 - Odkrycie
- 1.2 - Rozwój przemysłowy
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd
- 2.2 Masa atomowa
- 2.3 Liczba atomowa (Z)
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość (temperatura pokojowa)
- 2.7 Ciepło topnienia
- 2.8 Ciepło parowania
- 2,9 Molowa pojemność cieplna
- 2.10 stopnie utlenienia
- 2.11 Elektroujemność
- 2.12 Energia jonizacji
- 2.13 Przewodność cieplna
- 2.14 Porządek magnetyczny
- 2.15 Izotopy
- 2.16 Fosforescencja
- 2.17 Zmiany alotropowe
- 2.18 Rozpuszczalność
- 2.19 Reaktywność
- 3 Struktura i konfiguracja elektroniczna
- 3.1 - Linki i jednostka czworościenna
- 3.2 - Allotropy
- 4 Gdzie znaleźć i otrzymać
- 4.1 Apatyt i fosforyt
- 4.2 Elektrotermiczna redukcja fluoroapatytu
- 5 stopów
- 5.1 Miedź
- 5.2 Brąz
- 5.3 Niklowane
- 6 Ryzyka
- 7 zastosowań
- 7.1 - Fosfor elementarny
- 7.2 - Związki
- 8 Odniesienia
Fabuła
- Odkrycie
W moczu

Fosfor został wyodrębniony przez Henninga Branda w 1669 roku, będąc pierwszym człowiekiem, który wyizolował pierwiastek. Brand był niemieckim alchemikiem z Hamburga i udało mu się uzyskać związek fosforu z moczu. Aby to zrobić, zebrał mocz z 50 wiader i pozwolił mu się rozłożyć.
Brand następnie odparował mocz i uzyskał czarnawą pozostałość, którą trzymał przez kilka miesięcy. Dodał do tego piasek i ogrzał go, usuwając gazy i oleje. W końcu uzyskał białą substancję stałą, która świeciła w ciemności na zielono, którą nazwał „zimnym ogniem”..
Termin „fosfor” przypadkowo pochodzi od greckiego słowa „fosfor”, które oznacza nośnik światła..
Brand nie publikował wyników swoich eksperymentów i sprzedawał je różnym alchemikom, w tym: Johannowi Kraftowi, Kunckelowi Lowensternowi i Wilhelmowi Leibnizowi. Prawdopodobnie część z nich zgłosiła prace Branda do Paryskiej Akademii Nauk, rozpowszechniając w ten sposób swoje badania.
Jednak Brand w rzeczywistości nie wyodrębnił fosforu, ale fosforan amoniakowo-sodowy [Na (NH4) PO4]. W 1680 roku Robert Boyle udoskonalił procedurę Branda, dzięki której był w stanie uzyskać alotropową formę fosforu (P4).
W kościach
Johan Gottlieb Gahn i Carl Wihelm Scheele ustalili w 1769 roku, że w kościach znaleziono związek fosforu, fosforan wapnia. Odtłuszczone kości zostały poddane procesowi trawienia mocnymi kwasami, np. Kwasem siarkowym.
Następnie produkt fermentacji ogrzewano w stalowych zbiornikach z węglem i węglem, uzyskując w ten sposób fosfor biały przez destylację w retortach. Kości były głównym źródłem fosforu do 1840 roku, kiedy to zastąpiono je w tym celu guanem..
W guano
Guano to mieszanka ptasich odchodów i produktów rozkładu ptaków. W XIX wieku był używany jako źródło fosforu i nawozów.
- Rozwój przemysłowy
Skały fosforowe zaczęto wykorzystywać w 1850 r. Jako źródło fosforu. To, wraz z wynalezieniem przez Jamesa Burgessa Readmana (1888) elektrycznego pieca do kalcynowania skał, uczyniło z fosforytów głównym surowcem do produkcji fosforu i nawozów..
W 1819 r. Powstały fabryki zapałek, co zapoczątkowało przemysłowy rozwój wykorzystania fosforu..
Fizyczne i chemiczne właściwości
Wygląd
W zależności od formy alotropowej może być bezbarwny, woskowobiały, żółty, szkarłatny, czerwony, fioletowy lub czarny.
Masa atomowa
30,973 u
Liczba atomowa (Z)
piętnaście
Temperatura topnienia
Fosfor biały: 44,15 ° C
Fosfor czerwony: ~ 590 ºC
Temperatura wrzenia
Fosfor biały: 280,5 ° C
Gęstość (temperatura pokojowa)
Biały: 1,823 g / cm3
Czerwony: 2,2-2,34 g / cm3
Fiolet: 2,36 g / cm3
Czarny: 2,69 g / cm3
Ciepło topnienia
Fosfor biały: 0,66 kJ / mol
Ciepło parowania
Fosfor biały: 51,9 kJ / mol
Molowa pojemność cieplna
Fosfor biały: 23,824 J / (mol.K)
Stany utleniania
-3, -2, -1, +1, +2, +3, +4 i +5
W zależności od elektroujemności pierwiastków, z którymi się łączy, fosfor może wykazywać stopień utlenienia +3 lub -3. Fosfor, w przeciwieństwie do azotu, ma tendencję do reagowania preferencyjnie na stopniu utlenienia +5; tak jest w przypadku pięciotlenku fosforu (PdwaLUB5 lub P.dwa5+LUB5dwa+).
Elektroujemność
2.19 w skali Paulinga
Energia jonizacji
-Pierwsza: 1101 kJ / mol
-Po drugie: 2190,7 kJ / mol
-Po trzecie: 2914 kJ / mol
Przewodność cieplna
Fosfor biały: 0,236 W / (mK)
Luminofor czarny: 12,1 W / (mK)
Pokazuje, jak czarny fosfor przewodzi prawie sześć razy więcej ciepła niż biały fosfor.
Porządek magnetyczny
Luminofory białe, czerwone, fioletowe i czarne są diamagnetyczne.
Izotopy
Fosfor ma 20 izotopów, z których najważniejsze to: 31P, jedyny stabilny izotop w ilości 100%; 32Izotop emitujący P, β- iz okresem półtrwania 14,28 dni; Y 33P, izotop emitujący β- iz okresem półtrwania 25,3 dni.
Fosforescencja
Luminofor biały jest fosforyzujący i w ciemności emituje zielone światło.
Zmiany alotropowe
Biały fosfor jest niestabilny i zmienia się w temperaturach bliskich 250 ° C do postaci polimerycznej znanej jako czerwony fosfor, który może mieć barwę od pomarańczowej do fioletowej. Jest to substancja bezpostaciowa, ale może stać się krystaliczna; nie świeci w ciemności ani nie pali się w powietrzu.
Fosfor biały w wysokich temperaturach i ciśnieniach lub w obecności katalizatorów przekształca się w postać polimeryczną inną niż fosfor czerwony: fosfor czarny. Jest to krystaliczna substancja koloru czarnego, obojętna, podobna do grafitu, która ma zdolność przewodzenia prądu.
Rozpuszczalność
Biały fosfor w czystej postaci jest nierozpuszczalny w wodzie, chociaż można go rozpuszczać w siarczku węgla. Tymczasem luminofory czerwone i czarne są nierozpuszczalne w wodzie i są mniej lotne niż fosfor biały..
Reaktywność
Fosfor spontanicznie spala się w powietrzu, tworząc P.dwaLUB5, a to z kolei może reagować z trzema cząsteczkami wody, tworząc kwas ortofosforowy lub fosforowy (H3PO4).
Pod wpływem gorącej wody fosfina (PH3) i tlenokwasów fosforu.
Kwas fosforowy działa na skały fosforanowe, powodując dwuwodorofosforan wapnia lub superfosfat [Ca (HdwaPO4)dwa].
Może reagować z halogenami tworząc halogenki PX3, X oznacza F, Cl, Br lub I; lub halogenki o wzorze PX5, gdzie X to F, Cl lub Br.
Fosfor reaguje również z metalami i metaloidami, tworząc fosforki oraz z siarką, tworząc różne siarczki. Z drugiej strony wiąże się z tlenem, tworząc estry. W ten sam sposób łączy się z węglem, tworząc organiczne związki fosforu..
Struktura i konfiguracja elektroniczna
- Wiązania i jednostka czworościenna
Atomy fosforu mają następującą konfigurację elektroniczną:
[Ne] 3sdwa 3p3
Dlatego ma pięć elektronów walencyjnych, takich jak azot i inne pierwiastki z grupy 15. Ponieważ jest to pierwiastek niemetaliczny, jego atomy muszą tworzyć wiązania kowalencyjne, aż do zakończenia oktetu walencyjnego. Azot osiąga to, ustanawiając się jako dwuatomowe cząsteczki Ndwa, z potrójnym wiązaniem, N≡N.
To samo dzieje się z fosforem: dwa z jego atomów P wiążą się potrójnym wiązaniem, tworząc cząsteczkę P.dwa, P≡P; to znaczy dwufosforowy alotrop. Jednak fosfor ma większą masę atomową niż azot, a jego orbitale 3p, bardziej rozproszone niż 2p azotu, zachodzą na siebie mniej efektywnie; dlatego Pdwa istnieje tylko w stanie gazowym.
Zamiast tego w temperaturze pokojowej atomy P wolą organizować się kowalencyjnie w inny sposób: w tetraedrycznej cząsteczce P.4:

Zauważ, że na górnym obrazku wszystkie atomy P mają trzy pojedyncze wiązania zamiast jednego potrójnego wiązania. Zatem fosfor w P.4 kończy swój oktet walencyjny. Jednak w P4 istnieje napięcie w wiązaniach P-P, ponieważ ich kąty są dalekie od 109,5 ° dla nieuzbrojonego oka.
- Allotropy
Fosfor biały
To samo zdjęcie jednostek P.4 a jego niestabilność wyjaśnia, dlaczego fosfor biały jest najbardziej niestabilnym alotropem tego pierwiastka.
Jednostki P4 są rozmieszczone w przestrzeni, aby zdefiniować kryształ bcc (faza α) w normalnych warunkach. Gdy temperatura spada do -77,95 ° C, kryształ bcc przekształca się w gęstszy hcp (przypuszczalnie) (faza β). Oznacza to, że jednostki P4 są ułożone w dwóch naprzemiennych warstwach, A i B, w celu ustalenia sekwencji ABAB ...
Fosfor czerwony
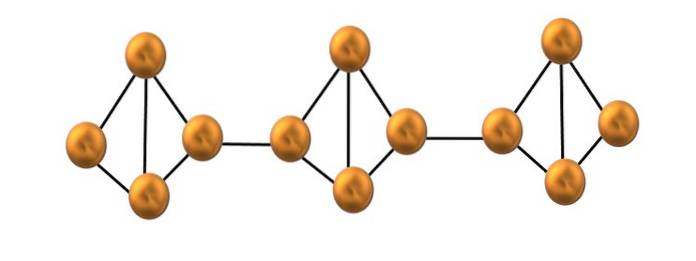
Na górnym obrazie pokazano tylko niewielki fragment struktury czerwonego fosforu. Ponieważ te trzy jednostki są ustawione „symetrycznie”, można powiedzieć, że jest to struktura krystaliczna, którą uzyskuje się przez podgrzanie tego luminoforu do temperatury powyżej 250 ° C..
Jednak czerwony fosfor w większości składa się z amorficznego ciała stałego, więc jego struktura jest niechlujna. Następnie łańcuchy polimerowe P.4 byłyby ułożone bez widocznego wzoru, niektóre powyżej, a inne poniżej tej samej płaszczyzny arbitralnie.
Zauważ, że jest to główna różnica strukturalna między fosforem białym i czerwonym: w pierwszym przypadku P4 są one indywidualne i znajdują się w drugich łańcuchach formujących. Jest to możliwe, ponieważ jedno z wiązań P-P w czworościanie jest przerywane, aby związać się z sąsiednim czworościanem. W ten sposób zmniejsza się napięcie pierścieniowe, a czerwony fosfor zyskuje większą stabilność..
Gdy występuje mieszanina obu alotropów, jest ona podawana do oka w postaci żółtego luminoforu; mieszanina czworościanów i amorficznych łańcuchów fosforowych. W rzeczywistości biały fosfor zmienia kolor na żółtawy pod wpływem promieni słonecznych, ponieważ promieniowanie sprzyja zerwaniu już wspomnianego wiązania P-P..
Luminofor fioletowy lub Hittorf
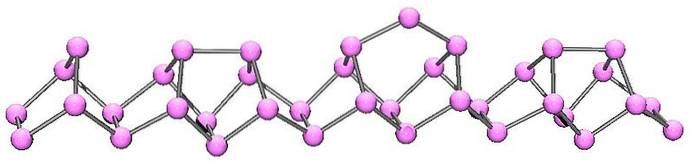
Fosfor fioletowy to ostateczna ewolucja fosforu czerwonego. Jak widać na powyższym obrazku, nadal składa się z łańcucha polimerowego; ale teraz struktury są bardziej skomplikowane. Wydaje się, że jednostka strukturalna nie jest już P4 ale Pdwa, ułożone w taki sposób, że tworzą nieregularne pięciokątne pierścienie.
Pomimo tego, jak asymetryczna jest struktura, te łańcuchy polimerowe potrafią układać się wystarczająco dobrze i okresowo, aby fioletowy luminofor tworzył jednoskośne kryształy..
Fosfor czarny
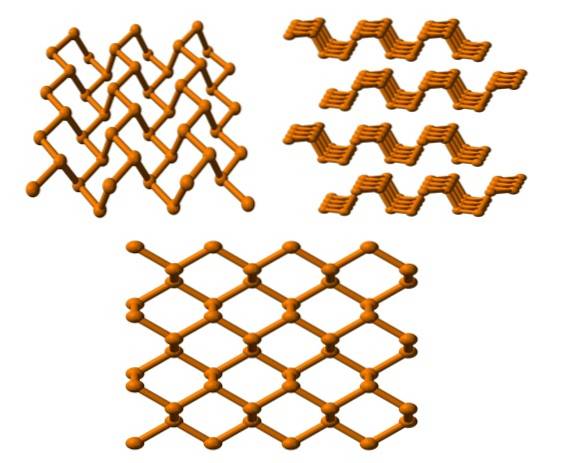
I wreszcie mamy najbardziej stabilny alotrop fosforu: czarny. Jest przygotowywany przez ogrzewanie białego fosforu pod ciśnieniem 12 000 atm.
Na górnym obrazku (poniżej) widać, że jego struktura z wyższej płaszczyzny jest do pewnego stopnia podobna do grafitu; to stroma sieć sześciokątnych pierścieni (nawet jeśli wyglądają jak kwadraty).
W lewym górnym rogu obrazu to, co zostało właśnie skomentowane, można lepiej docenić. Molekularne otoczenie atomów P to piramidy trygonalne. Zwróć uwagę, że konstrukcja widziana z boku (prawy górny róg) jest ułożona w warstwach, które pasują do siebie.
Struktura czarnego fosforu jest dość symetryczna i uporządkowana, co jest zgodne z jego zdolnością do tworzenia kryształów rombowych. Układanie ich warstw polimerowych sprawia, że atomy P są niedostępne dla wielu reakcji chemicznych; i dlatego jest dość stabilny i mało reaktywny.
Chociaż warto wspomnieć, siły dyspersji Londynu i masy molowe tych stałych fosforu są tym, co reguluje niektóre z ich właściwości fizycznych; podczas gdy ich struktura i wiązania P-P określają właściwości chemiczne i inne.
Gdzie znaleźć i uzyskać
Apatyt i fosforyt
Jest dwunastym elementem skorupy ziemskiej i stanowi 0,1% jej wagi. Istnieje około 550 minerałów zawierających fosfor, przy czym apatyt jest najważniejszym minerałem do pozyskiwania fosforu..
Apatyt to minerał fosforu i wapnia, który może zawierać zmienne ilości fluoru, chlorków i wodorotlenków, których wzór jest następujący: [Ca10(PO4)6(F, Cl lub OH)dwa)]. Oprócz apatytu istnieją inne minerały fosforu o znaczeniu handlowym; tak jest w przypadku wavelita i vivianita.
Głównym źródłem fosforu są fosforyty lub fosforyty. Jest to pozbawiona uszkodzeń skała osadowa o zawartości fosforu 15–20%. Fosfor jest zwykle obecny w postaci Ca10(PO4)6fadwa (fluoroapatyt). Występuje również w postaci hydroksyapatytu, choć w mniejszym stopniu.
Ponadto fluoroapatyt można znaleźć jako część skał magmowych i metamorficznych, a także wapieni i łupków..
Elektrotermiczna redukcja fluoroapatytu
Wybrane skały fosforanowe przekazywane są do oczyszczalni w celu przetworzenia. Początkowo są kruszone w celu uzyskania skalistych fragmentów, które są następnie mielone w młynach kulowych z prędkością 70 obrotów na minutę.
Następnie produkt rozdrabniania fragmentów skały przesiewa się w celu umożliwienia ich frakcjonowania. Te frakcje o zawartości fosforu 34% wybiera się jako pięciotlenek fosforu (PdwaLUB5).
Fosfor biały (P.4) jest otrzymywany na skalę przemysłową przez elektrotermiczną redukcję fluoroapatytu węglem w temperaturze 1500 ° C w obecności tlenku krzemu:
2Ca3(PO4)dwa(s) + 6SiOdwa(s) + 10 C (s) => P4(g) + CaSiO3(l) + CO (g)
P4 w stanie gazowym po skropleniu zbiera się i magazynuje w postaci białej substancji stałej zanurzonej w wodzie, aby nie reagowała z powietrzem zewnętrznym.
Stopy
Miedziany
Kożuch fosforowy jest produkowany z różnymi procentami miedzi i fosforu: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15% itp. Stop jest używany jako odtleniacz, środek zwilżający w przemyśle miedziowym, a także jako zarodek krystalizacji w przemyśle aluminiowym.
Broncíneas
Są to stopy miedzi, fosforu i cyny zawierające 0,5 - 11% fosforu i 0,01 - 0,35% cyny. Cyna zwiększa odporność na korozję, a fosfor zwiększa odporność stopu na ścieranie i nadaje mu sztywność.
Jest stosowany do produkcji sprężyn, śrub i ogólnie w artykułach wymagających odporności na zmęczenie, zużycie i korozję chemiczną. Zaleca się jego użycie w śrubach napędowych łodzi.
Niklowane
Najbardziej znanym stopem jest NiPdwadzieścia, stosowanie niklu fosforowego w stopach lutowniczych w celu poprawy ich odporności na erozję chemiczną, utlenianie i wysokie temperatury.
Stop jest stosowany w elementach turbin gazowych i silników odrzutowych, do galwanotechniki oraz do produkcji elektrod spawalniczych.
Ryzyka
Biały fosfor powoduje poważne oparzenia skóry i jest silną trucizną, która może być śmiertelna w dawce 50 mg. Fosfor hamuje utlenianie komórek, zakłócając zarządzanie tlenem komórkowym, co może prowadzić do zwyrodnienia tłuszczowego i śmierci komórek.
Ostre zatrucie fosforem powoduje w ciągu pierwszych czterech dni po połknięciu ból brzucha, pieczenie, oddech pachnący czosnkiem, fosforyzujące wymioty, pocenie się, skurcze mięśni, a nawet stan szoku..
Później żółtaczka, wybroczyny, krwotoki, zajęcie mięśnia sercowego z zaburzeniami rytmu serca, zmiany w ośrodkowym układzie nerwowym i śmierć dziesiątego dnia po spożyciu..
Najbardziej oczywistym objawem przewlekłego zatrucia fosforem jest uszkodzenie struktury kostnej szczęki.
U pacjentów z niewydolnością nerek występuje zwykle wzrost stężenia fosforu w osoczu (hiperfosfatemia). Powoduje to nieprawidłowe odkładanie się fosforanów w tkankach miękkich, co może prowadzić do dysfunkcji naczyń i chorób układu krążenia..
Aplikacje
Fosfor jest podstawowym pierwiastkiem dla roślin i zwierząt. Jest jednym z trzech głównych składników pokarmowych roślin, niezbędnym do ich wzrostu i zapotrzebowania energetycznego. Ponadto wchodzi w skład kwasów nukleinowych, fosfolipidów, produktów pośrednich procesów metabolicznych itp..
U kręgowców fosfor występuje w kościach i zębach w postaci hydroksyloapatytu..
- Fosfor elementarny

Za pomocą fosforu wytwarza się emalię chemiczną, która służy do oświetlania znaków umieszczonych na aluminium i jego stopach; a także miedź i brąz fosforowy.
Służy również do produkcji bomb zapalających, granatów, bomb dymnych i kul smugowych. Fosfor czerwony jest używany do zapałek lub zapałek bezpiecznych.
Fosfor biały jest używany do produkcji fosforanów organicznych. Ponadto jest używany do produkcji kwasu fosforowego.
Duża ilość wyprodukowanego fosforu jest spalana w celu produkcji czterotlenku fosforu (P.4LUB10), otrzymany w postaci proszku lub ciała stałego.
- Związki
Fosfina
Jest surowcem do produkcji różnych związków fosforu. Działa jako środek dopingujący do elementów elektronicznych.
Kwas fosforowy
Wykorzystywany jest do produkcji napojów bezalkoholowych ze względu na charakterystyczny smak, jaki im nadaje. Działa na skały fosforanowe, tworząc dwuwodorofosforan wapnia [Ca (HdwaPO4)dwa], znany również jako superfosfat, który jest używany jako nawóz.
Kwas fosforowy to składnik kondycjonujący szkliwo zębów, ułatwiający przyleganie materiałów do odbudowy. Jest również używany, zmieszany z olejem, mocznikiem, smołą, bitumem i piaskiem, do utworzenia asfaltu; materiał stosowany przy remoncie lądowych ciągów komunikacyjnych.
Fosforany organiczne
Związki fosforoorganiczne mają liczne zastosowania; takich jak: środki zmniejszające palność, pestycydy, środki ekstrakcyjne, środki działające na nerwy i do uzdatniania wody.
Dwuwodorofosforan wapnia, dwuwodny
Stosowany jest jako nawóz, proszek do pieczenia, dodatek do pasz dla zwierząt oraz do produkcji past do zębów.
Pięciotlenek fosforu
Jest stosowany w analizie chemicznej jako środek odwadniający oraz w syntezie organicznej jako środek kondensujący. Związek przeznaczony jest przede wszystkim do produkcji kwasu ortofosforowego.
Trójpolifosforan sodu
Stosowany w detergentach oraz jako zmiękczacz wody, który poprawia działanie detergentów i pomaga zapobiegać korozji rur.
Fosforan trisodowy
Używany jako środek czyszczący i zmiękczacz wody.
Fosforany sodu
Fosforan sodu dwuzasadowy (NadwaHPO4) i jednozasadowy fosforan sodu (NaHdwaPO4) są składnikami układu buforowego pH, który działa nawet na żywe istoty; w tym istoty ludzkie.
Bibliografia
- Reid Danielle. (2019). Alotropy fosforu: formy, zastosowania i przykłady. Nauka. Odzyskany z: study.com
- Prof. Robert J. Lancashire. (2014). Wykład 5c. Budowa pierwiastków, ciąg dalszy P, S i I. Pobrano z: chem.uwimona.edu.jm
- BYJU. (2019). Fosfor czerwony. Odzyskany z: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang i wsp. (2019). Elektroniczne właściwości strukturalne i optyczne wielowarstwowego niebieskiego fosforu: badanie pierwszej zasady. Journal of Nanomaterials, vol. 2019, numer artykułu 4020762, 8 stron. doi.org/10.1155/2019/4020762
- Dr Dough Stewar. (2019). Fakty dotyczące pierwiastka fosforu. Chemicool. Źródło: chemicool.com
- Wikipedia. (2019). Fosfor. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (03 lipca 2019). Fakty dotyczące fosforu (liczba atomowa 15 lub symbol pierwiastka P). Odzyskany z: thinkco.com
- Linus Pauling Institute. (2019). Fosfor. Odzyskany z: lpi.oregonstate.edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.f.). Krajowe przetwarzanie fosforytu do produkcji superfosfatu. [PDF]. Odzyskany z: bdigital.unal.edu.co
- Redaktorzy Encyclopaedia Britannica. (16 listopada 2018). Pierwiastek chemiczny fosforu. Encyclopædia Britannica. Odzyskany z: britannica.com
- Reade International Corp. (2018). Stop miedzi i fosforu (CuP). Odzyskany z: reade.com
- KBM Affilips. (27 grudnia 2018). Stop niklowo-fosforowy (NiP) Master Alloy. AZoM. Odzyskany z: azom.com
- Lenntech B.V. (2019). Układ okresowy: fosfor. Odzyskany z: lenntech.com
- Abhijit Naik. (2018, 21 lutego). Zastosowania fosforu. Odzyskany z: sciencestruck.com



Jeszcze bez komentarzy