
Historia kalorymetru, części, typy i ich charakterystyka
Plik kalorymetr to urządzenie służące do pomiaru zmiany temperatury pewnej ilości substancji (zwykle wody) o znanym cieple właściwym. Ta zmiana temperatury wynika z pochłonięcia lub uwolnienia ciepła w badanym procesie; chemiczna, jeśli jest to reakcja, lub fizyczna, jeśli składa się z fazy lub zmiany stanu.
W laboratorium najprostszym kalorymetrem, jaki można znaleźć, jest ten ze szklanki do kawy. Służy do pomiaru ciepła pochłoniętego lub uwolnionego w reakcji pod stałym ciśnieniem w roztworze wodnym. Reakcje dobiera się tak, aby uniknąć interwencji odczynników lub produktów gazowych.
Ilość ciepła oddanego w reakcji = ilość ciepła pochłonięta przez kalorymetr + ilość ciepła pochłonięta przez roztwór
Ilość ciepła pochłoniętego przez kalorymetr nazywana jest pojemnością kalorymetru kalorymetru. Określa się to dostarczając znaną ilość ciepła do kalorymetru z zadaną masą wody. Następnie wzrost temperatury kalorymetru i roztworu zawierającego.
Na podstawie tych danych i wykorzystania ciepła właściwego wody (4,18 J / g ° C) można obliczyć pojemność kaloryczną kalorymetru. Ta pojemność jest również nazywana stałą kalorymetru.
Z drugiej strony, ciepło uzyskane przez roztwór wodny jest równe m · ce · Δt. We wzorze m = masa wody, ce = ciepło właściwe wody, a Δt = zmiana temperatury. Wiedząc to wszystko, możesz obliczyć ilość ciepła uwolnionego w wyniku reakcji egzotermicznej.
Indeks artykułów
- 1 Historia kalorymetru
- 2 części
- 3 Rodzaje i ich cechy
- 3.1 Szklanka kawy
- 3.2 Bomba kalorymetryczna
- 3.3 Kalorymetr adiabatyczny
- 3.4 Kalorymetr izoperibolu
- 3.5 Kalorymetr przepływu
- 3.6 Kalorymetr do różnicowej kalorymetrii skaningowej
- 4 Aplikacje
- 4.1 W fizykochemii
- 4.2 W systemach biologicznych
- 4.3 Kalorymetr z pompą tlenową i moc kaloryczna
- 5 Referencje
Historia kalorymetru
W 1780 r. Francuski chemik A. L. Lavoisier, uważany za jednego z ojców chemii, użył świnki morskiej do pomiaru produkcji ciepła poprzez oddychanie..
W jaki sposób? Korzystanie z urządzenia podobnego do kalorymetru. O cieple wytwarzanym przez świnkę morską świadczyło topnienie śniegu otaczającego aparat.
Badacze A.L Lavoisier (1743-1794) i P. S. Laplace (1749-1827) zaprojektowali kalorymetr, który był używany do pomiaru ciepła właściwego ciała metodą topnienia lodu.
Kalorymetr składał się z cylindrycznego, lakierowanego kubka blaszanego, wspartego na trójnogu i zakończonego wewnętrznie lejkiem. Wewnątrz umieszczono kolejną szklankę, podobnie jak poprzednią, z rurką przechodzącą przez zewnętrzną komorę i zaopatrzoną w klucz. W drugiej szklance znajdowała się kratka.
Istota lub przedmiot, którego ciepło właściwe miało zostać określone, został umieszczony na tej siatce. Lód został umieszczony wewnątrz koncentrycznych kieliszków, podobnie jak w koszu.
Ciepło wytwarzane przez ciało zostało wchłonięte przez lód, powodując jego stopienie. I zebrano ciekły wodny produkt topnienia lodu, otwierając wewnętrzny szklany kran.
I wreszcie woda zważyła się, znana była masa stopionego lodu.
Części
Najpowszechniej stosowanym kalorymetrem w laboratoriach dydaktycznych chemii jest tzw. Kalorymetr z filiżanką kawy. Ten kalorymetr składa się z zlewki lub zamiast pojemnika z materiału anime, który ma pewne właściwości izolacyjne. Wewnątrz tego pojemnika znajduje się wodny roztwór wraz z ciałem, które ma wytwarzać lub absorbować ciepło.
W górnej części pojemnika znajduje się wieko wykonane z materiału izolacyjnego z dwoma otworami. W jednej umieszczono termometr do pomiaru zmian temperatury, aw drugiej mieszadło, najlepiej wykonane ze szkła, które pełni funkcję przesuwania zawartości roztworu wodnego..
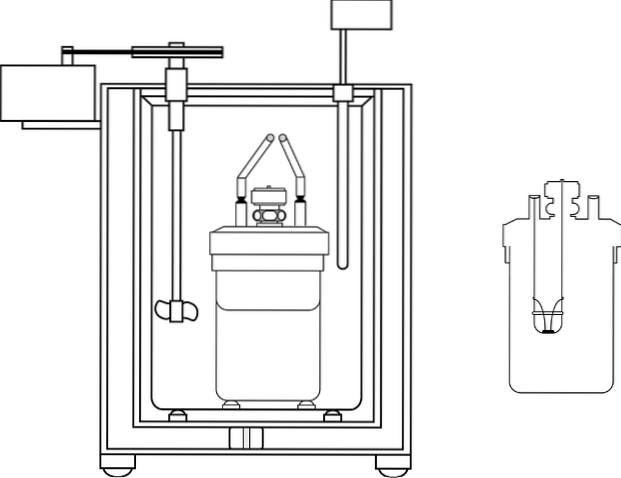
Zdjęcie przedstawia części kalorymetru bomby; Widać jednak, że ma termometr i mieszadło, wspólne elementy w kilku kalorymetrach.
Rodzaje i ich cechy
Filiżanka kawy
Jest to metoda wykorzystywana do określania ciepła uwalnianego w wyniku reakcji egzotermicznej oraz ciepła pochłanianego w reakcji endotermicznej..
Ponadto może być używany do określania ciepła właściwego ciała; to znaczy ilość ciepła, jaką musi wchłonąć gram substancji, aby podnieść temperaturę o jeden stopień Celsjusza. .
Bomba kalorymetryczna
Jest to urządzenie, w którym mierzona jest ilość ciepła, które jest oddawane lub pochłaniane w reakcji zachodzącej przy stałej objętości.
Reakcja zachodzi w solidnym stalowym pojemniku (pompie), który jest zanurzony w dużej objętości wody. Dzięki temu zmiany temperatury wody są niewielkie. Dlatego zakłada się, że zmiany związane z reakcją są mierzone przy stałej objętości i temperaturze..
Powyższe wskazuje, że żadna praca nie jest wykonywana, gdy reakcja jest przeprowadzana w kalorymetrze bombowym.
Reakcja zaczyna się od dostarczenia energii elektrycznej przewodami podłączonymi do pompy.
Kalorymetr adiabatyczny
Charakteryzuje się strukturą izolacyjną zwaną osłoną. Osłona znajduje się wokół komórki, w której zachodzą zmiany ciepła i temperatury. Podobnie jest podłączony do układu elektronicznego, który utrzymuje temperaturę bardzo zbliżoną do temperatury ogniwa, aby uniknąć wymiany ciepła..
W kalorymetrze adiabatycznym różnica temperatur między kalorymetrem a jego otoczeniem jest zminimalizowana; a także minimalizowanie współczynnika przenikania ciepła i czasu wymiany ciepła.
Jego części składają się z następujących elementów:
-Ogniwo (lub pojemnik) zintegrowane z systemem izolacyjnym, za pomocą którego stara się uniknąć strat ciepła.
-Termometr do pomiaru zmian temperatury.
-Grzejnik podłączony do kontrolowanego źródła napięcia elektrycznego.
-I tarcza, o której już wspomniano.
W tego typu kalorymetrze można określić takie właściwości, jak entropia, temperatura Debye'a i gęstość elektronowa stanu..
Kalorymetr izoperibolu
Jest to urządzenie, w którym komora reakcyjna i pompa są zanurzone w konstrukcji zwanej płaszczem. W tym przypadku tzw. Płaszcz składa się z wody utrzymywanej w stałej temperaturze.
Temperatura ogniw i pomp rośnie, gdy ciepło jest uwalniane podczas procesu spalania; ale temperatura płaszcza wodnego jest utrzymywana na stałym poziomie.
Mikroprocesor kontroluje temperaturę ogniwa i płaszcza, dokonując niezbędnych poprawek na ciepło wycieku, które wynika z różnic między dwiema temperaturami..
Te poprawki są stosowane w sposób ciągły, z ostateczną korektą, na podstawie pomiarów przed i po teście..
Kalorymetr przepływu
Opracowany przez Caliendar ma urządzenie do przesuwania gazu w pojemniku ze stałą prędkością. Dodając ciepło, mierzony jest wzrost temperatury w płynie.
Kalorymetr przepływu charakteryzuje się:
- Dokładny pomiar prędkości stałego przepływu.
- Dokładny pomiar ilości ciepła wprowadzanego do płynu przez grzałkę.
- Dokładny pomiar wzrostu temperatury gazu spowodowanego poborem energii
- Projekt do pomiaru pojemności gazu pod ciśnieniem.
Kalorymetr do różnicowej kalorymetrii skaningowej
Charakteryzuje się posiadaniem dwóch pojemników: w jednym umieszcza się badaną próbkę, w drugim jest pusty lub używany jest materiał odniesienia..
Oba naczynia są ogrzewane ze stałą szybkością energii za pomocą dwóch niezależnych grzejników. Kiedy oba zbiorniki zaczną się nagrzewać, komputer wykreśli różnicę w przepływie ciepła z grzejników w zależności od temperatury, umożliwiając w ten sposób określenie przepływu ciepła..
Ponadto można określić zmianę temperatury w funkcji czasu; i wreszcie pojemność kaloryczna.
Aplikacje
W fizykochemii
-Podstawowe kalorymetry typu filiżanki do kawy pozwalają zmierzyć ilość ciepła, które ciało oddaje lub pochłania. W nich można określić, czy reakcja jest egzotermiczna, czy endotermiczna. Ponadto można określić ciepło właściwe ciała.
-Za pomocą kalorymetru adiabatycznego można było określić entropię procesu chemicznego i gęstość elektronową stanu.
W układach biologicznych
-Mikrokalorymetry są używane do badania układów biologicznych, które obejmują interakcje między cząsteczkami, a także zachodzące zmiany konformacyjne w cząsteczkach; na przykład podczas rozwijania cząsteczki. Linia obejmuje zarówno przemiatanie różnicowe, jak i miareczkowanie izotermiczne.
-Mikrokalorymetr jest stosowany przy opracowywaniu leków małocząsteczkowych, bioterapeutyków i szczepionek.
Kalorymetr z pompą tlenu i moc kaloryczna
W kalorymetrze z bombą tlenową następuje spalanie wielu substancji i można określić ich wartość kaloryczną. Wśród substancji badanych za pomocą tego kalorymetru są: węgiel i koks; oleje jadalne, zarówno ciężkie, jak i lekkie; benzyna i wszystkie paliwa silnikowe.
Jak również rodzaje paliw do reaktorów lotniczych; odpady paliwowe i usuwanie odpadów; produkty spożywcze i dodatki do żywienia ludzi; uprawy paszowe i dodatki do pasz dla zwierząt; Materiały budowlane; paliwa rakietowe i materiały miotające.
Podobnie, moc kaloryczną określono za pomocą kalorymetrii w badaniach termodynamicznych materiałów palnych; w badaniu bilansu energetycznego w ekologii; w materiałach wybuchowych i prochach termicznych oraz w nauczaniu podstawowych metod termodynamicznych.
Bibliografia
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning.
- González J., Cortés L. & Sánchez A. (s.f.). Kalorymetria adiabatyczna i jej zastosowania. Odzyskany z: cenam.mx
- Wikipedia. (2018). Kalorymetr. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (22 czerwca 2018). Definicja kalorymetru w chemii. Odzyskany z: thinkco.com
- Gillespie, Claire. (11 kwietnia 2018). Jak działa kalorymetr? Nauka. Odzyskany z: sciencing.com



Jeszcze bez komentarzy