
Struktura węglanu litu (Li2CO3), właściwości, zastosowanie

Plik węglan litu jest nieorganicznym ciałem stałym utworzonym przez dwa kationy litu Li+ i anion węglanowy CO3dwa-. Jego wzór chemiczny to LidwaWSPÓŁ3. LidwaWSPÓŁ3 jest białą krystaliczną substancją stałą, którą można otrzymać w reakcji wodorotlenku litu i dwutlenku węgla.
Węglan litu ma bardzo wysoką temperaturę topnienia, dlatego znajduje zastosowanie w produkcji szkieł, ceramiki i porcelany. Znajduje szerokie zastosowanie, np. W akumulatorach litowych wielokrotnego ładowania, do wytwarzania innych związków litu, w elektrodach spawalniczych oraz w farbach i lakierach..

Li jest również używanydwaWSPÓŁ3 w mieszankach cementowych do szybkiego wiązania i produkcji aluminium.
Jednym z jego najważniejszych zastosowań jest leczenie niektórych chorób psychicznych, takich jak między innymi depresja i nadmiernie agresywne zachowania..
Jednak jego stosowanie jako leku musi być należycie kontrolowane przez lekarzy specjalistów, ponieważ osoby leczone LidwaWSPÓŁ3 może mieć szkodliwy wpływ na zdrowie, np. niedoczynność tarczycy (osłabienie czynności tarczycy).
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości fizyczne
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Rozkład
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 3,7 pH
- 4 Właściwości chemiczne
- 5 Właściwości biologiczne
- 6 Otrzymywanie
- 7 zastosowań
- 7.1 W leczeniu chorób psychicznych
- 7.2 W leczeniu objawów innych chorób
- 7.3 Sposób podawania
- 8 Niekorzystne skutki
- 8.1 Przypadki, w których nie należy go podawać
- 9 Inne zastosowania
- 10 Referencje
Struktura
Węglan litu składa się z dwóch kationów litu+ i anion węglanowy CO3dwa-.
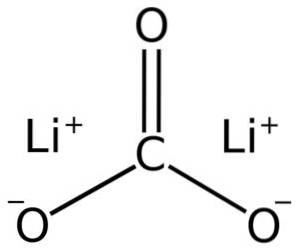
Konfiguracja elektronowa litu na stopniu utlenienia +1 wynosi 1sdwa 2s0, ponieważ stracił elektron z ostatniej powłoki, dzięki czemu jest bardziej stabilny. Jon węglanowy CO3dwa- ma płaską strukturę.
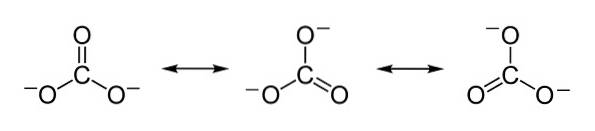
Ujemne ładunki są równomiernie rozłożone na trzy atomy tlenu jonu węglanowego CO3dwa-.
Nomenklatura
-Węglan litu
-Węglan dilitu
Właściwości fizyczne
Stan fizyczny
Białe krystaliczne ciało stałe o strukturze jednoskośnej
Waga molekularna
73,9 g / mol
Temperatura topnienia
723 ºC
Rozkład
Rozkłada się w temperaturze 1300 ºC.
Gęstość
2,11 g / cm3
Rozpuszczalność
Słabo rozpuszczalny w wodzie: 1,31% wag. W 20 ° C. Jego rozpuszczalność w wodzie maleje wraz ze wzrostem temperatury. Jest rozpuszczalny w rozcieńczonych kwasach. Jest nierozpuszczalny w alkoholu i acetonie.
pH
Roztwory wodne są alkaliczne, mają pH większe niż 7.
Właściwości chemiczne
LidwaWSPÓŁ3 hydrolizuje w roztworze wodnym tworząc roztwór zasadowy. Niewielka część związku rozpuszczonego w wodzie pozostawia anion węglanowy wolny od CO.3dwa-.
Anion węglanowy CO3dwa- wolny w roztworze wodnym przyjmuje proton, tworząc anion wodorowęglanowy HCO3-, jak widać w następującej reakcji:
WSPÓŁ3dwa- + H.dwaO → HCO3- + O-
Obecność jonów OH- to właśnie sprawia, że rozwiązanie jest podstawowe.
Właściwości biologiczne
Ślady jonu litu są zwykle obecne w tkankach zwierząt i ludzi, ale jak dotąd nie jest znana naturalna fizjologiczna rola tego jonu..
W organizmie ludzkim LidwaWSPÓŁ3 przyjmowany jako lek działa na różne mechanizmy sygnalizacyjne w neuronach i innych komórkach. Wynika to z zastąpienia kationów, takich jak sód i potas.
Włączenie jonu litu do struktury błony komórkowej może zmienić odpowiedź na hormony i sprzężenie komórki z procesami energetycznymi.
W ten sposób lit modyfikuje kilka procesów komórkowych, w tym metabolizm..
Poprzez modyfikację sposobu funkcjonowania komórek, LidwaWSPÓŁ3 może wpływać na mechanizmy komunikacyjne neuronów w mózgu.
Otrzymywanie
LidwaWSPÓŁ3 można otrzymać w reakcji wodorotlenku litu LiOH z dwutlenkiem węgla COdwa, jak pokazano niżej:
2 LiOH + COdwa → LidwaWSPÓŁ3 + H.dwaLUB
Jest produkowany komercyjnie z minerałów zawierających lit, takich jak spodumen i lepidolit. Te minerały są poddawane działaniu pewnych soli siarczanowych lub związków alkalicznych w wysokich temperaturach w celu uzyskania soli litu..
Otrzymane sole litu oczyszcza się wodą lub roztworami kwasu, a następnie poddaje obróbce węglanami w celu utworzenia LidwaWSPÓŁ3.
Jednak LidwaWSPÓŁ3 Uzyskany w ten sposób zanieczyszczony jest siarczanami lub chlorkami wapnia, magnezu, żelaza, sodu, potasu itp. więc wymaga dalszego oczyszczenia.
Aplikacje
W leczeniu chorób psychicznych
Stosowany jest jako środek przeciwdepresyjny, antymaniczny, w leczeniu zachowań agresywno-impulsywnych oraz w zaburzeniach afektywnych dwubiegunowych (osoby, które nagle zmieniają nastrój bez przyczyny, stają się agresywne).

Lekarze zaobserwowali, że jego podawanie prowadzi do zmniejszenia intensywności i częstotliwości ciężkich okresów depresji i epizodów maniakalnych..
Jest stosowany samodzielnie, to znaczy bez dodatku związku, w leczeniu podtrzymującym depresji jednobiegunowej oraz w zaburzeniach schizoafektywnych. Służy również wzmocnieniu przeciwdepresyjnego działania innych leków.
Chociaż był stosowany w leczeniu dzieci z widocznymi objawami choroby afektywnej dwubiegunowej i nadpobudliwością z komponentami nerwicowymi lub agresywnymi, nie był skuteczny we wszystkich przypadkach..
W leczeniu objawów innych chorób
Stosowany jest w celu zmniejszenia częstości występowania silnych, nawracających i przewlekłych bólów głowy.
Jest stosowany w celu zmniejszenia częstości zakażeń u pacjentów z neutropenią wywołaną chemioterapią lub z innych powodów. Neutropenia to zmniejszenie liczby neutrofili, rodzaju białych krwinek, które pomagają zwalczać infekcje w organizmie.
Był stosowany jako inhibitor enzymów tarczycy w leczeniu nadczynności tarczycy, ale nie jest preferowanym leczeniem ze względu na niekorzystne skutki.
Forma administracji
Jest stosowany w postaci tabletek lub kapsułek LidwaWSPÓŁ3. Również w tabletkach o powolnym uwalnianiu z cytrynianem litu. Li jest preferowanydwaWSPÓŁ3 ponieważ nie podrażnia gardła po połknięciu, jak ma to miejsce w przypadku innych soli litu.

Niekorzystne skutki
LidwaWSPÓŁ3 może mieć szkodliwy wpływ na tarczycę i nerki, dlatego czynność tych narządów powinna być monitorowana przed i w trakcie leczenia tym związkiem..
LidwaWSPÓŁ3 może być toksyczny w stężeniach bardzo zbliżonych do stężeń stosowanych w leczeniu, dlatego wymagany jest ciągły przegląd jego wartości w surowicy krwi.
Objawy zatrucia LidwaWSPÓŁ3 drżenie, skurcze mięśni, osłabienie mięśni, biegunka, wymioty, senność lub ataksja (upośledzona koordynacja mięśni), między innymi.
Rozpoczynając terapię LidwaWSPÓŁ3 Mogą również wystąpić objawy, takie jak drżenie, bóle głowy i nudności. Ale te mają tendencję do zanikania w miarę kontynuowania leczenia..
U większości leczonych osób może również rozwinąć się leukocytoza (wzrost liczby białych krwinek), ale jest to odwracalne..
Ludzie, którzy są leczeni LidwaWSPÓŁ3 nie powinni prowadzić pojazdów ani obsługiwać maszyn, ponieważ zmniejsza się koordynacja fizyczna i zdolność do wykonywania czynności wymagających czujności.
Przypadki, w których nie należy go podawać
Nie należy go stosować u dzieci poniżej 12 roku życia, ponieważ może wpływać na tworzenie kości i ich gęstość, ponieważ zmienia stężenie hormonu tarczycy. Ma również tendencję do zajmowania miejsca wapnia w kościach..
Nie należy ich leczyć LidwaWSPÓŁ3 osoby z chorobami układu krążenia, nerek lub tarczycy. Ani u ciężko odwodnionych pacjentów.
Nie należy go podawać kobietom w ciąży, zwłaszcza w pierwszym trymestrze ciąży. Lit przenika przez łożysko i może łatwo dotrzeć do płodu z możliwym działaniem teratogennym, to znaczy może powodować nieprawidłowości lub wady rozwojowe u nienarodzonego dziecka..
Osoby w podeszłym wieku wymagające leczenia LidwaWSPÓŁ3 należy leczyć z dużą ostrożnością i dawkami niższymi niż u młodych dorosłych, ponieważ mogą rozwinąć się u nich niedoczynność tarczycy.
Inne zastosowania
LidwaWSPÓŁ3 wysoka czystość jest szeroko stosowana w produkcji akumulatorów litowych.
Używany w ogniwach paliwowych ze stopionym węglanem.
Służy do produkcji porcelany elektrotechnicznej, która jest rodzajem porcelany elektroizolacyjnej. Znajduje również zastosowanie w produkcji szkliwa na ceramice.

Pozwala na przygotowanie ceramiki o niskim współczynniku rozszerzalności, czyli rozszerza się bardzo mało wraz ze wzrostem temperatury, dzięki czemu ceramikę można stosować w wyższym zakresie temperatur.
Inne zastosowania to katalizator, produkcja innych związków litu, powłoka elektrod spawalniczych, luminescencyjne receptury farb, lakierów i barwników, a także elektrolityczna produkcja aluminium..
Przydaje się, aby przyspieszyć wiązanie cementu i jest dodawany do kleju do płytek, dzięki czemu można je naprawić w krótkim czasie.

Bibliografia
- Cai, W. i in. (2018). Usunięcie SO4dwa- od LidwaWSPÓŁ3 przez rekrystalizację w NadwaWSPÓŁ3. Crystals 2018, 8, 19. Odzyskane z mdpi.com.
- Gadikota, G. (2017). Łączenie zmian morfologicznych i strukturalnych kryształów podczas konwersji monohydratu wodorotlenku litu do węglanu litu przy użyciu wieloskalowych pomiarów rozpraszania promieniowania rentgenowskiego. Minerały 2017, 7, 169. Odzyskane z mdpi.com.
- NAS. National Library of Medicine. (2019). Węglan litu. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.



Jeszcze bez komentarzy