
Struktura, właściwości, produkcja, zastosowania kwasu chromowego

Plik kwas chromowy lub H.dwaCrO4 jest to teoretycznie kwas związany z tlenkiem chromu (VI) lub tlenkiem chromu CrO3. Ta nazwa wynika z faktu, że gatunek H.dwaCrO4 występuje razem z innymi gatunkami chromu (VI).
Tlenek chromu CrO3 nazywany jest również bezwodnym kwasem chromowym. CrO3 to czerwonawo-brązowe lub fioletowe ciało stałe otrzymywane przez obróbkę roztworów dichromianu potasu K.dwaCrdwaLUB7 z kwasem siarkowym H.dwapołudniowy zachód4.

Wodne roztwory tlenku chromu doświadczają równowagi pewnych związków chemicznych, których stężenie zależy od pH roztworu. Przy zasadowym pH dominują jony chromianowe CrO4dwa-, podczas gdy przy pH kwaśnym dominują jony HCrO4- i dichromian CrdwaLUB7dwa-. Szacuje się, że przy kwaśnym pH występuje również kwas chromowy H.dwaCrO4.
Ze względu na dużą siłę utleniającą roztwory kwasu chromowego są wykorzystywane w chemii organicznej do przeprowadzania reakcji utleniania. Są również wykorzystywane w procesach elektrochemicznych do obróbki metali w sposób zapewniający ich odporność na korozję i zużycie..
Niektóre materiały polimerowe są również traktowane kwasem chromowym, aby poprawić ich przyczepność do metali, farb i innych substancji..
Roztwory kwasu chromowego są bardzo niebezpieczne dla ludzi, większości zwierząt i środowiska. Z tego powodu płynne lub stałe odpady z procesów, w których stosowany jest kwas chromowy, są poddawane obróbce w celu usunięcia śladów chromu (VI) lub w celu odzyskania całego obecnego chromu i regeneracji kwasu chromowego do ponownego użycia..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3.6 Inne właściwości
- 4 Chemia roztworów wodnych, w których występuje kwas chromowy
- 5 Otrzymywanie
- 6 Zastosowania kwasu chromowego
- 6.1 W utlenianiu związków chemicznych
- 6.2 W procesach anodowania metali
- 6.3 W obróbce konwersji chemicznej
- 6.4 Na powierzchniach zerodowanych lub wżerowych
- 6.5 Do różnych zastosowań
- 7 Odzysk kwasu chromowego
- 7.1 Przy użyciu żywic
- 7.2 Poprzez regenerację elektrochemiczną
- 8 Wykorzystanie mikroorganizmów do czyszczenia ścieków ze śladami kwasu chromowego
- 9 Zagrożenia związane z kwasem chromowym i tlenkiem chromu
- 10 Referencje
Struktura
Cząsteczka kwasu chromowego H.dwaCrO4 tworzony jest przez jon chromianowy CrO4dwa- i dwa jony wodorowe H.+ dołączony do tego. W jonie chromianowym pierwiastek Chrom jest na stopniu utlenienia +6.
Przestrzenna struktura jonu chromianowego jest tetraedryczna, w której chrom znajduje się w środku, a tlenki zajmują cztery wierzchołki czworościanu..
W kwasie chromowym każdy atom wodoru zawiera tlen. Z czterech wiązań chromu z atomami tlenu, dwa są podwójne, a dwa proste, ponieważ mają przyłączone do nich atomy wodoru.
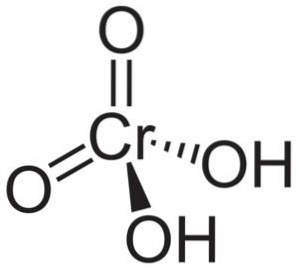
Z drugiej strony tlenek chromu CrO3 posiada atom chromu na +6 stopniu utlenienia otoczony tylko trzema atomami tlenu.
Nomenklatura
- Kwas chromowy H.dwaCrO4
- Kwas tetraoksochromowy H.dwaCrO4
- Tlenek chromu (bezwodny kwas chromowy) CrO3
- Trójtlenek chromu (bezwodny kwas chromowy) CrO3
Nieruchomości
Stan fizyczny
Bezwodny kwas chromowy lub tlenek chromu to krystaliczna substancja stała od fioletowej do czerwonej
Waga molekularna
CrO3: 118,01 g / mol
Temperatura topnienia
CrO3: 196 ° C
Powyżej temperatury topnienia jest niestabilny termicznie, traci tlen (jest redukowany) dając tlenek chromu (III) CrdwaLUB3. Rozkłada się w temperaturze około 250 ºC.
Gęstość
CrO3: 1,67-2,82 g / cm3
Rozpuszczalność
CrO3 jest bardzo dobrze rozpuszczalny w wodzie: 169 g / 100 g wody o temperaturze 25 ºC.
Jest rozpuszczalny w kwasach mineralnych, takich jak siarkowy i azotowy. Rozpuszczalny w alkoholu.
Inne właściwości
CrO3 jest bardzo higroskopijny, jego kryształy rozpływają się.
Kiedy CrO3 rozpuszcza się w wodzie, tworzy roztwory silnie kwaśne.
To bardzo silny utleniacz. Energicznie utlenia materię organiczną w prawie wszystkich jej formach. Działa niszcząco na tkaniny, skórę i niektóre tworzywa sztuczne. Atakuje również większość metali.
Jest silnie trujący i bardzo drażniący ze względu na wysoki potencjał utleniający..
Chemia roztworów wodnych, w których występuje kwas chromowy
Tlenek chromu CrO3 szybko rozpuszcza się w wodzie. W roztworze wodnym chrom (VI) może występować w różnych formach jonowych.
Przy pH> 6,5 lub w roztworze alkalicznym chrom (VI) uzyskuje jon chromianowy w postaci CrO4dwa- żółty.
Jeśli pH jest obniżone (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , który może dimeryzować do jonu dichromianowego CrdwaLUB7dwa-, a roztwór zmieni kolor na pomarańczowy. Przy pH między 2,5 a 5,5 dominującymi gatunkami są HCrO4- i CRdwaLUB7dwa-.

Bilanse, które występują w tych roztworach wraz ze spadkiem pH, są następujące:
CrO4dwa- (jon chromianowy) + H.+ ⇔ HCrO4-
HCrO4- + H.+ ⇔ H.dwaCrO4 (kwas chromowy)
2HCrO4- ⇔ CrdwaLUB7dwa- (jon dwuchromianowy) + H.dwaLUB
Równowagi te występują tylko wtedy, gdy kwasem dodanym w celu obniżenia pH jest HNO3 lub HClO4, ponieważ z innymi kwasami powstają różne związki.
Kwaśne roztwory dichromianu są bardzo silnymi utleniaczami. Ale w roztworach alkalicznych jon chromianowy jest znacznie mniej utleniający.
Otrzymywanie
Według konsultowanych źródeł, jeden ze sposobów otrzymywania tlenku chromu CrO3, Polega ona na dodaniu kwasu siarkowego do wodnego roztworu dichromianu sodu lub potasu, z utworzeniem czerwono-pomarańczowego osadu..

Kwas chromowy H.dwaCrO4 Występuje w wodnych roztworach tlenku chromu w środowisku kwaśnym.
Zastosowania kwasu chromowego
W utlenianiu związków chemicznych
Ze względu na silną zdolność utleniania kwas chromowy od dawna jest z powodzeniem stosowany do utleniania związków organicznych i nieorganicznych..
Wśród niezliczonych przykładów można wymienić: umożliwia utlenianie alkoholi pierwszorzędowych do aldehydów i tych do kwasów karboksylowych, alkoholi drugorzędowych do ketonów, toluenu do kwasu benzoesowego, etylobenzenu do acetofenonu, trifenylometanu do trifenylokarbinolu, kwasu mrówkowego do COdwa, kwas szczawiowy do COdwa, kwas mlekowy do aldehydu octowego i COdwa, jon żelazawy Fedwa+ na jon żelazowy Fe3+, jodek do jodu itp.
Pozwala na konwersję związków nitrozowych do nitrozwiązków, siarczków w sulfony. Bierze udział w syntezie ketonów począwszy od alkenów, gdyż utlenia hydroborowane alkeny do ketonów.
Związki wysoce odporne na zwykłe utleniacze, takie jak tlen O.dwa lub nadtlenek wodoru H.dwaLUBdwa, są utleniane przez kwas chromowy. Tak jest w przypadku niektórych heterocyklicznych boranów.
W procesach anodowania metali
Anodowanie w kwasie chromowym to elektrochemiczna obróbka aluminium w celu ochrony go przez wiele lat przed utlenianiem, korozją i zużyciem..
Proces anodowania polega na elektrochemicznym tworzeniu warstwy tlenku glinu lub tlenku glinu na metalu. Warstwa ta jest następnie uszczelniana w gorącej wodzie, dzięki czemu uzyskuje się konwersję do trójwodzianu tlenku glinu..
Uszczelniona warstwa tlenku jest gruba, ale strukturalnie słaba i niezbyt zadowalająca do późniejszego sklejania. Jednak dodanie niewielkiej ilości kwasu chromowego do wody uszczelniającej tworzy powierzchnię, która może tworzyć dobre połączenia..
Kwas chromowy zawarty w wodzie uszczelniającej rozpuszcza część gruboziarnistej struktury komórkowej i pozostawia cienką, mocną, mocno przylegającą warstwę tlenku glinu, do której kleje przylegają i tworzą mocne i trwałe połączenia..
Anodowanie w kwasie chromowym dotyczy również tytanu i jego stopów.
W obróbce konwersji chemicznej
Kwas chromowy jest stosowany w procesach powlekania metali metodą konwersji chemicznej.
Podczas tego procesu metale zanurza się w roztworach kwasu chromowego. To reaguje i częściowo rozpuszcza powierzchnię, osadzając cienką warstwę złożonych związków chromu, które oddziałują z metalem podstawowym..
Proces ten nazywany jest chromianowaniem konwersyjnym lub chromianowaniem konwersyjnym..
Metale, które są generalnie poddawane chromowaniu konwersyjnemu, to różne rodzaje stali, takie jak stal węglowa, stal nierdzewna i stal ocynkowana, a także różne metale nieżelazne, takie jak stopy magnezu, stopy cyny, stopy aluminium, miedź. , kadm, mangan i srebro.
Ta obróbka zapewnia metalowi odporność na korozję i połysk. Im wyższe pH procesu, tym większa odporność na korozję. Temperatura przyspiesza reakcję kwaśną.
Można nakładać powłoki w różnych kolorach, np. Niebieskim, czarnym, złotym, żółtym i bezbarwnym. Zapewnia również lepszą przyczepność powierzchni metalowej do farb i klejów.
Na powierzchniach zerodowanych lub wżerowych
Roztwory kwasu chromowego służą do przygotowania powierzchni przedmiotów wykonanych z materiałów termoplastycznych, termoutwardzalnych polimerów i elastomerów do ich późniejszego powlekania farbami lub klejami..
HdwaCrO4 ma wpływ na chemię powierzchni i jej strukturę, sprzyja zwiększeniu jej szorstkości. Połączenie wżerów i utleniania zwiększa penetrację klejów, a nawet może powodować zmiany właściwości polimeru..
Został użyty do erodowania rozgałęzionego polietylenu o małej gęstości, liniowego polietylenu o dużej gęstości i polipropylenu.
Jest szeroko stosowany w przemyśle galwanicznym lub galwanicznym w celu ułatwienia adhezji metal-polimer.
W różnych zastosowaniach
Kwas chromowy jest stosowany jako środek konserwujący do drewna, także w materiałach magnetycznych oraz do katalizy reakcji chemicznych.
Odzysk kwasu chromowego
Istnieje wiele procesów wykorzystujących kwas chromowy i generujących strumienie lub pozostałości zawierające chrom (III), których nie można usunąć, ponieważ zawierają jony chromu (VI), które są bardzo toksyczne, ani nie można ich ponownie wykorzystać, ponieważ stężenie jonów chromianowych jest bardzo duże. Niska..
Ich utylizacja wymaga chemicznej redukcji chromianów do chromu (III), a następnie wytrącania wodorotlenku i filtracji, co generuje dodatkowe koszty.
Z tego powodu zbadano różne metody usuwania i odzyskiwania chromianów. Oto kilka z nich.
Za pomocą żywic
Żywice jonowymienne są używane od wielu lat do uzdatniania wody zanieczyszczonej chromianami. Jest to jeden z zabiegów zatwierdzonych przez Agencję Ochrony Środowiska Stanów Zjednoczonych lub EPA. Agencja Ochrony Środowiska).
Ta metoda pozwala na odzysk stężonego kwasu chromowego, ponieważ jest on ponownie regenerowany z żywicy..
Żywice mogą być mocne lub słabe. W żywicach silnie zasadowych chromian można usunąć dzięki obecności jonów HCrO4- i CRdwaLUB7dwa- są wymieniane na jony OH- i Cl-. W żywicach słabo zasadowych, na przykład żywicach siarczanowych, jony są wymieniane na SO4dwa-.
W przypadku silnie zasadowych żywic R- (OH) ogólne reakcje są następujące:
2ROH + HCrO4- + H.+ ⇔ R.dwaCrO4 + 2HdwaLUB
RdwaCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4dwa-
RdwaCrO4 + HCrO4- + H.+ ⇔ R.dwaCrdwaLUB7 + H.dwaLUB
Za każdy mol R.dwaCrO4 po konwersji jeden mol Cr (VI) jest usuwany z roztworu, co czyni tę metodę bardzo atrakcyjną..
Po usunięciu chromianów żywicę poddaje się działaniu silnie alkalicznego roztworu, aby zregenerować je w bezpiecznym miejscu. Następnie chromiany są przekształcane w stężony kwas chromowy do ponownego wykorzystania..
Poprzez regenerację elektrochemiczną
Inną metodą jest elektrochemiczna regeneracja kwasu chromowego, która jest również bardzo wygodną alternatywą. W tym procesie chrom (III) jest utleniany anodowo do chromu (VI). W takich przypadkach materiałem anodowym jest korzystnie dwutlenek ołowiu..
Stosowanie mikroorganizmów do oczyszczania ścieków ze śladami kwasu chromowego
Metodą, która została zbadana i nadal jest badana, jest wykorzystanie mikroorganizmów naturalnie występujących w niektórych ściekach zanieczyszczonych sześciowartościowymi jonami chromu, które są zawarte w roztworach kwasu chromowego..

Tak jest w przypadku niektórych bakterii obecnych w ściekach z garbowania skór. Mikroby te zostały przebadane i ustalono, że są odporne na chromiany, a także są zdolne do redukcji chromu (VI) do chromu (III), który jest znacznie mniej szkodliwy dla środowiska i istot żywych..
Z tego powodu szacuje się, że można je stosować jako przyjazną środowisku metodę remediacji i detoksykacji ścieków zanieczyszczonych śladowymi ilościami kwasu chromowego..
Zagrożenia związane z kwasem chromowym i tlenkiem chromu
CrO3 Nie jest palny, ale może nasilać spalanie innych substancji. Wiele z ich reakcji może spowodować pożar lub wybuch.
CrO3 i roztwory kwasu chromowego silnie podrażniają skórę (mogą powodować zapalenie skóry), oczy (mogą się palić) i błony śluzowe (mogą powodować oskrzela) i mogą powodować tak zwane „dziury chromowe” w układzie oddechowym.
Związki chromu (VI), takie jak kwas chromowy i tlenek chromu, są silnie toksyczne, mutagenne i rakotwórcze dla większości żywych istot..
Bibliografia
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- NAS. National Library of Medicine. (2019). Kwas chromowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. oraz Van Twisk, J. (2013). Aluminium i stopy aluminium. 2.5. Proces anodowania kwasem chromowym. W technikach przygotowania powierzchni do klejenia (wydanie drugie). Odzyskany z sciencedirect.com.
- Wegman, R.F. oraz Van Twisk, J. (2013). Magnez. 6.4. Przygotowanie magnezu i stopów magnezu w procesach obróbki kwasem chromowym. W technikach przygotowania powierzchni do klejenia (wydanie drugie). Odzyskany z sciencedirect.com.
- Grot, W. (2011). Aplikacje. 5.1.8. Regeneracja kwasu chromowego. W fluorowanych jonomerach (drugie wydanie). Odzyskany z sciencedirect.com.
- Swift, K.G. i Booker, J.D. (2013). Procesy inżynierii powierzchni. 9.7. Chromowanie. W podręczniku doboru procesu produkcyjnego. Odzyskany z sciencedirect.com.
- Poulsson, A.H.C. et al. (2019). Techniki modyfikacji powierzchni PEEK, w tym obróbka powierzchni plazmą. 11.3.2.1. Wytrawianie powierzchni. W Podręczniku biomateriałów PEEK (wydanie drugie). Odzyskany z sciencedirect.com.
- Westheimer, F.H. (1949). Mechanizmy utleniania kwasu chromowego. Recenzje chemiczne 1949, 45, 3, 419–451. Odzyskany z pubs.acs.org.
- Tan, H.K.S. (1999). Usuwanie kwasu chromowego przez wymianę anionów. The Canadian Journal of Chemical Engineering, tom 77, luty 1999. Źródło: onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Izolacja i charakterystyka bakterii redukujących chrom (VI) ze ścieków garbarskich i stałych. World Journal of Microbiology and Biotechnology (2018) 34: 126. Odzyskany z ncbi.nlm.nih.gov.


Jeszcze bez komentarzy