
Formuła kwasu hipojodowego (HIO), właściwości i zastosowanie

Plik kwas hipojodowy, znany również jako monoksojodan wodoru (I) lub jodol, jest związkiem nieorganicznym o wzorze HIO. Jest to tlenokwas jodu, zawierający atom tlenu, atom wodoru i atom jodu o stopniu utlenienia 1+.
Związek jest bardzo niestabilny, ponieważ ma skłonność do reakcji dysmutacji, w której jest redukowany do jodu cząsteczkowego i utleniany do kwasu jodowego zgodnie z reakcją: 5HIO → 2Idwa + HIO3 + 2HdwaLUB.
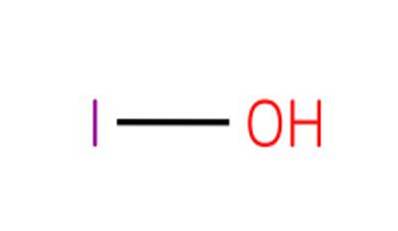
Związek ten jest najsłabszym kwasem spośród tlenokwasów halogenowych o stopniu utlenienia 1+. Odpowiednie sole tego kwasu są znane jako podjodity.
Sole te są trwalsze niż kwas i powstają podobnie jak ich chlorowe i bromowe odpowiedniki, w wyniku reakcji molekularnego jodu z wodorotlenkami metali alkalicznych lub ziem alkalicznych..
Kwas hipo-jodowy powstaje w wyniku reakcji molekularnego jodu z tlenkiem rtęci (II) (Egon Wiberg, 2001) zgodnie z reakcją:
2Idwa + 3HgO + HdwaO → 2HIO + HgIdwa ● 2HgO
Ślady tego związku uzyskuje się również w reakcji jodu cząsteczkowego z wodorotlenkiem potasu, z wytworzeniem początkowo jodku potasu i podjodanu potasu zgodnie z reakcją:
jadwa + 2KOH → KI + KIO
Jednak kwas podjodowy, będący tak słabym kwasem, umożliwia hydrolizę podjodanu potasu, chyba że występuje nadmiar wodorotlenku potasu (Holmyard, 1922).
KIO + HdwaO → HIO + KOH
Można go również otrzymać, podobnie jak jego odpowiedniki z chlorem i bromem, w reakcji jodu cząsteczkowego z wodą. Jednak biorąc pod uwagę jego niską stałą równowagi, która jest rzędu 10-13, otrzymane ilości są bardzo małe (R.G. Compton, 1972).
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 2 Reaktywność i zagrożenia
- 3 Zastosowania
- 4 Odnośniki
Fizyczne i chemiczne właściwości
Kwas hipojodynowy występuje tylko w postaci wodnego roztworu o żółtawym kolorze. Związek w stanie stałym nie został wyodrębniony, więc większość jego właściwości teoretycznie uzyskuje się za pomocą obliczeń obliczeniowych (National Center for Biotechnology Information, 2017).
Kwas podjodowy ma masę cząsteczkową 143,911 g / mol, temperaturę topnienia 219,81 ° C, temperaturę wrzenia 544,27 ° C i prężność par 6,73 x 10-14 milimetry słupa rtęci.
Cząsteczka jest bardzo dobrze rozpuszczalna w wodzie, będąc w stanie rozpuścić się między 5,35 x 105 i 8,54 x 105 gramów związku na litr tego rozpuszczalnika (Royal Society of Chemistry, 2015).
HOI jest silnym utleniaczem i może tworzyć wybuchowe mieszaniny. Jest również środkiem redukującym i może być utleniany do jodu, jodu i okresowych postaci kwasu. W roztworach wodnych, będąc słabym kwasem, częściowo dysocjuje na jon podjodytu (OI-) i H+.
HOI reaguje z zasadami, tworząc sole zwane podjodytami. Na przykład podjodan sodu (NaOI) powstaje w reakcji kwasu podjodowego z wodorotlenkiem sodu..
HOI + NaOH → NaOI + HdwaLUB
Kwas hipojodowy łatwo reaguje również z różnymi cząsteczkami organicznymi i biomolekułami..
Reaktywność i zagrożenia
Kwas hipojodowy jest niestabilnym związkiem rozkładającym się do pierwiastkowego jodu. Jod jest związkiem toksycznym, z którym należy obchodzić się ostrożnie.
Kwas hipojodowy jest niebezpieczny w przypadku kontaktu ze skórą (drażniący), w kontakcie z oczami (drażniący) oraz w przypadku połknięcia i wdychania.
W przypadku kontaktu z oczami sprawdź, czy nosisz soczewki kontaktowe i natychmiast je zdejmij. Oczy należy przepłukiwać bieżącą wodą przez co najmniej 15 minut, trzymając powieki otwarte. Można użyć zimnej wody. Nie należy stosować maści do oczu.
Jeśli substancja chemiczna wejdzie w kontakt z ubraniem, zdejmij ją tak szybko, jak to możliwe, chroniąc własne ręce i ciało. Umieść ofiarę pod prysznicem bezpieczeństwa.
Jeśli substancja chemiczna gromadzi się na odsłoniętej skórze ofiary, takiej jak ręce, zanieczyszczoną skórę należy delikatnie i ostrożnie umyć pod bieżącą wodą i nieściernym mydłem. Można użyć zimnej wody. Jeśli podrażnienie utrzymuje się, zasięgnąć porady lekarza. Wyprać zanieczyszczoną odzież przed ponownym użyciem.
W przypadku silnego kontaktu ze skórą należy ją przemyć mydłem dezynfekującym, a skażoną skórę pokryć kremem antybakteryjnym..
W przypadku wdychania poszkodowanego należy pozwolić odpocząć w dobrze wentylowanym miejscu. Jeśli wdychanie jest ciężkie, ofiarę należy jak najszybciej ewakuować w bezpieczne miejsce. Poluzuj ciasną odzież, taką jak kołnierzyk koszuli, pasek lub krawat.
Jeśli ofiara ma trudności z oddychaniem, należy podać tlen. Jeśli ofiara nie oddycha, przeprowadza się resuscytację usta-usta. Zawsze należy pamiętać, że wykonanie resuscytacji usta-usta może być niebezpieczne dla osoby udzielającej pomocy, gdy wdychany materiał jest toksyczny, zakaźny lub żrący..
W przypadku połknięcia nie wywoływać wymiotów. Poluzuj ciasne ubrania, takie jak kołnierzyki koszuli, paski lub krawaty. Jeśli ofiara nie oddycha, przeprowadzić resuscytację usta-usta.
We wszystkich przypadkach zasięgnij natychmiastowej pomocy lekarskiej..
Aplikacje
Kwas hipojodowy jest używany jako silny środek utleniający i reduktor w reakcjach laboratoryjnych. Służy do produkcji związków chemicznych zwanych podjodytami..
Metody spektrofotometryczne są również stosowane do pomiaru tworzenia kwasu hipojodowego w celu monitorowania reakcji, w których bierze udział jod (T. L. Allen, 1955).
Halogenki są włączane do aerozoli, gdzie rozpoczynają katalityczną destrukcję ozonu (O3) nad oceanami i wpływają na globalną troposferę. Dwa intrygujące problemy środowiskowe będące przedmiotem trwających badań to: zrozumienie, w jaki sposób halogeny molekularne w reaktywnej fazie gazowej są wytwarzane bezpośrednio z nieorganicznych halogenków wystawionych na działanie O3 i ograniczyć czynniki środowiskowe, które kontrolują ten proces międzyfazowy.
W pracy (Elizabeth A. Pillar, 2013) dokonano pomiaru przemiany jodku do kwasu hipojodowego przez działanie ozonu za pomocą pomiarów spektroskopii masowej w celu określenia modelu ubytku ozonu w atmosferze..
Bibliografia
- Egon Wiberg, N. W. (2001). Chemia nieorganiczna. Londyn: prasa akademicka.
- Elizabeth A. Pillar, M. I. (2013). Konwersja jodku do kwasu hipojodowego i jodu w wodnych mikrokropelkach wystawionych na działanie ozonu. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5 stycznia). kwas podjodowaty. Pobrane z ChEBI: ebi.ac.uk.
- Holmyard, E. (1922). Chemia nieorganiczna. Londyn: Edwar Arnol & co.
- National Center for Biotechnology Information… (22 kwietnia 2017). Baza danych PubChem Compound; CID = 123340. Odzyskane z PubChem.
- G. Compton, C. B. (1972). Reakcje niemetalicznych związków nieorganicznych. Ansterdam: Elsevier Publishing Company.
- Królewskie Towarzystwo Chemii. (2015). Jodol. Pobrane z chemspider.com.
- L. Allen, R. M. (1955). Tworzenie kwasu podjodowego i kationów uwodnionego jodu przez hydrolizę jodu. J. Am. Chem. Soc., 77 (11) , 2957-2960.


Jeszcze bez komentarzy