
Właściwości, reakcje i zastosowania kwasu krzemowego

Plik kwas krzemowy jest to uwodniona forma tlenku krzemu. Jest to ogólna nazwa rodziny związków chemicznych utworzonych przez krzem oraz pewną ilość cząsteczek wodoru i tlenu..
Ogólny wzór tych kwasów to [SiOx(O)4-2x]n, a najczęstszą postacią, w której zwykle występuje, jest kwas ortokrzemowy H4tak4.
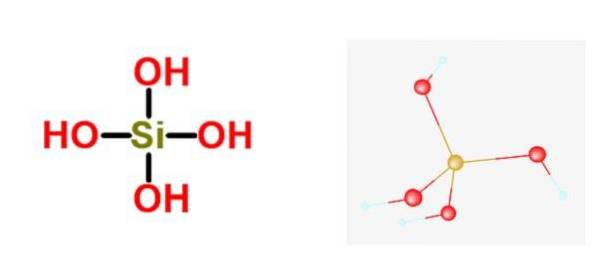
Kwas krzemowy należy do rodziny różnych krzemianów. Oznacza to, że największym metalicznym oksoanionem jest krzemian i nie jest do niego przyłączony żaden niemetaliczny atom. Istnieją pojedyncze przypadki, w których mają jeden niemetaliczny atom, ale nigdy więcej niż jeden.
Właściwości fizyczne kwasu krzemowego
Kwas krzemowy występuje tylko w dwóch stanach, bezpostaciowym i krystalicznym. Pierwszą uzyskuje się w procesie wytrącania, a drugą przedstawia jako kryształ górski.
Kwas krzemowy w postaci amorficznej (SiO3) jest biały, bez smaku, nierozpuszczalny w wodzie i nie tworzy z cząsteczkami samej siebie spójnej masy plastycznej, jak to ma miejsce w przypadku aluminium.
W stanie krystalicznym nie jest rozpuszczany przez żaden tlenokwas. Gdy bardzo rozcieńczony roztwór krzemionki zostanie potraktowany kwasem siarkowym, azotowym lub solnym, kwas krzemowy nie wytrąca się. Zamiast tego wydaje się, że rozpuszcza się w wodzie w postaci hydratu.
Po dodaniu roztworu kwasu lub kwasu do roztworu krzemianu hydrat wytrąca się w postaci galaretowatej, który po wysuszeniu, a następnie ogrzaniu z dużą energią, staje się substancją nierozpuszczalną.
Reakcje chemiczne
Kwas krzemowy jest wyjątkowo słaby i traci swój pierwszy proton, gdy osiąga pH 10. Tylko 3 znane reakcje z tym kwasem zachodzą w normalnych fizjologicznych warunkach życia..
- Reakcja z samym sobą, gdy rozpuszczalność zostanie przekroczona, tworząc bezpostaciowy hydrat krzemionki.
- Jego reakcja z wodorotlenkiem glinu z wytworzeniem wodorotlenku krzemianu glinu.
- Reakcja z nadmiarem molibdenianu z utworzeniem heteropolikwasów, takich jak silikomolibdenian.
Gdzie znajduje się kwas krzemowy?
Po tlenie najpowszechniejszym pierwiastkiem w przyrodzie jest krzem, występujący w postaci kryształów. W środowisku wodnym staje się niejonizujący, więc sole krzemu w oceanie mogą zakwaszać krzem i tworzyć kwas krzemowy..
Stwierdzono, że wkład netto kwasu krzemowego do światowego oceanu wynosi 6,1 ± 2,0 teramoli krzemu rocznie (1 teramol = 1012 moli). Prawie 80% tego wkładu pochodzi z rzek, których średnie stężenie na świecie wynosi 150 mikromoli (stężenie w wodzie).
W nowoczesnych osadach morskich uzysk netto biogennego krzemu (przemiana rozpuszczonego krzemianu w cząsteczkowy materiał szkieletowy) wynosi 7,1 ± 1,8 teramola na rok.
Produkcja brutto krzemionki biogennej w wodach powierzchniowych wynosi 240 ± 40 teramoli krzemu rocznie, a współczynnik zachowania (nagromadzenie opalesów w osadach / produkcja brutto w wodach powierzchniowych) wynosi 3%..
We florze można go znaleźć w roślinie Borago officinalis (Borraje), który w swoim składzie zawiera do 2,2% kwasu krzemowego.
Kwas ortokrzemowy jest najpowszechniejszą formą kwasu krzemowego, który można znaleźć w wielu różnych miejscach. Największe dostępne biologicznie źródła tego kwasu znajdują się w wodzie, albo w wodzie morskiej, albo w innych napojach, takich jak piwo..
Aby otrzymać go w laboratorium, postępuje się zgodnie z tą samą zasadą, co w oceanie, można go otrzymać przez zakwaszenie krzemianu sodu w roztworze wodnym..
Zastosowania w życiu codziennym
Pasta do zębów
Jest to żel ścierny stosowany w paście do zębów lub w przezroczystej części porysowanej pasty do zębów, ponieważ w połączeniu z węglanem wapnia pomaga bezpiecznie usunąć płytkę nazębną szczoteczką.
Jest zarejestrowany jako bezpieczny związek w Amerykańskiej Agencji ds. Żywności i Leków i nie ma znanej toksyczności ani rakotwórczości.
Środek pochłaniający wilgoć
Po wysuszeniu w piekarniku traci wodę i staje się środkiem osuszającym (substancją, która zasysa wodę z powietrza). Dlatego małe opakowania kryształów żelu krzemionkowego można znaleźć w pojemnikach, których zawartość może zostać uszkodzona przez wilgoć, takich jak butelki z witaminami, elektronika, buty lub produkty skórzane..
Inne zastosowania
Można go znaleźć w sklepach z pamiątkami, takich jak magiczne kamienie, ogród chemiczny lub ogród kryształowy. Jego suchą postać miesza się z solami różnych metali.
Sód wrzucany do wody jest zastępowany metalem, a ponieważ krzemian metalu nie jest rozpuszczalny w wodzie, tworzy się osad o charakterystycznym kolorze metalu. Krzemian metalu również rozszerza się w postaci żelu i rośnie w wodzie jako kolorowe stalagmity..
Korzyści medyczne wynikające z kwasu ortokrzemowego (OBS)
Kwas ortokrzemowy jest najlepszym biologicznie przyswajalnym podłożem silikonowym dla ludzi. Może być stosowany w leczeniu różnych schorzeń, takich jak choroba Alzheimera, zapalenie stawów, miażdżyca tętnic, nadciśnienie, choroby serca, osteoporoza, udar i włosy.
Zdrowe kości
W badaniu z 2008 roku na 136 kobietach z osteopenią codziennie przez rok podawano im kwas ortokrzemowy wraz z wapniem i witaminą D lub placebo. Po roku uczestnicy, którzy otrzymali kwas, poprawili tworzenie się kości.
Naukowcy twierdzą, że jest to spowodowane zdolnością kwasu ortokrzemowego do stymulowania produkcji kolagenu (białka znajdującego się w tkance łącznej) i promowania rozwoju komórek tworzących kości..
Zdrowie włosów
Małe badanie opublikowane w 2007 roku sugeruje, że kwas ten może pomóc poprawić jakość i zdrowie włosów. W badaniu 48 kobiet z „cienkimi włosami” podzielono na dwie grupy i przez dziewięć miesięcy podawano placebo lub suplement ortokrzemowy..
Naukowcy odkryli, że kwas ortosalicylowy wydaje się zwiększać wytrzymałość i grubość włosów. Ogólnie jakość włosów poprawiła się również dzięki suplementacji kwasem ortosalicylowym.
Bibliografia
- Narodowe Centrum Informacji Biotechnologicznej. Baza danych PubChem Compound; CID = 14942. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Graham, T. (1863). O właściwościach kwasu krzemowego i innych analogicznych substancji koloidalnych. Proceedings of the Royal Society of London, 13, 335-341. Odzyskane z: jstor.org.
- The Editors of Encyclopedia Britannica (1998) Silicic Acid Chemical Compound. Encyklopedia Britannica. Odzyskany z: britannica.com.
- Tomsofmaine.com. (2017). Uwodniona krzemionka | Tom's of Maine. [online] Odzyskane z: tomsofmaine.com.
- William Thomas Brande, Alfred Swaine Taylor. Chemia. Blanchard i Lea. [online] Pobrane 21 marca 2017 r. z books.google.co.ve.id.
- Field, S. (2017). Uwodniona krzemionka. [online] Pobrane 22 marca 2017 z: sci-toys.com.



Jeszcze bez komentarzy