
Budowa, funkcje i choroby kwasu sialowego
Plik kwasy sialowe są to monosacharydy o dziewięciu atomach węgla. Należą do rodziny pochodnych kwasu neuraminowego (kwas 5-amino-3,5-dideoksy-D-glicero-D-galakto-nonulozonowy) i są szeroko rozpowszechnione w przyrodzie, szczególnie w królestwie zwierząt.
Zwykle nie występują jako wolne cząsteczki, ale są połączone wiązaniami α-glukozydowymi z cząsteczkami węglowodanów lub innymi cząsteczkami kwasu sialowego, a następnie mogą zajmować końcowe lub wewnętrzne pozycje w liniowym łańcuchu węglowodanowym.
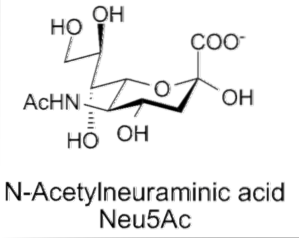
Termin „kwas sialowy” został po raz pierwszy wymyślony przez Gunnara Blixa w 1957 r., Chociaż wcześniejsze raporty innych badaczy wskazują, że jego odkrycie datuje się na dekadę lub dwie wcześniej, kiedy opisano je jako część glikoprotein mucyny sialo i singolipidów sialosialo sialo (gangliozydy ).
Kwasy sialowe są obecne w większości królestw natury. Zostały wykryte w niektórych wirusach, bakteriach chorobotwórczych, pierwotniakach, skorupiakach, płazińcach, owadach i kręgowcach, takich jak ryby, płazy, ptaki i ssaki. Wręcz przeciwnie, nie znaleziono ich w grzybach, algach czy roślinach..
Indeks artykułów
- 1 Struktura
- 2 Funkcje
- 2.1 Rola w procesach adhezji komórek
- 2.2 Rola w czasie życia składników krwinek
- 2.3 Role w układzie odpornościowym
- 2.4 Inne funkcje
- 3 Choroby
- 4 Odnośniki
Struktura
Kwasy sialowe występują głównie w końcowej części powierzchniowych glikoprotein i glikolipidów, zapewniając tym glikokoniugatom dużą różnorodność. Różnicowe wzorce „sialilacji” są produktami ekspresji specyficznych dla tkanki glikozylotransferaz (sialilotransferaz).
Strukturalnie kwasy sialowe należą do rodziny około 40 naturalnych pochodnych kwasu neuraminowego, które są N-acylowane, dając początek dwóm strukturom „macierzystym”: kwasowi N-acetyloneuraminowemu (Neu5Ac) lub kwasowi N-glikolilo-neuraminowemu (Neu5Gc).
Jego cechy strukturalne obejmują obecność grupy aminowej (którą można modyfikować) w pozycji 5 i grupy karboksylowej w pozycji 1, która może ulegać jonizacji przy fizjologicznym pH. Odtleniony węgiel C-3 i cząsteczka glicerolu w pozycji C-6.
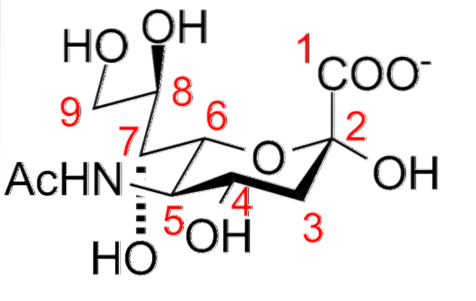
Wiele pochodnych powstaje w wyniku podstawienia grup hydroksylowych w pozycjach C-4, C-7, C-8 i C-9 przez części acetylowe, glikolowe, laktylowe, metylowe, siarczanowe i fosforanowe; a także wprowadzenie podwójnych wiązań między C-2 i C-3.
W liniowej pozycji końcowej, przyłączenie części kwasu sialowego do łańcucha oligosacharydowego obejmuje wiązanie α-glukozydowe między grupą hydroksylową atomu węgla C-2 anomerycznego kwasu sialowego a grupami hydroksylowymi atomów węgla C-3, C- , 4 lub C-6 części monosacharydowej.
Te wiązania mogą zachodzić między resztami galaktozy, N-acetyloglukozaminą, N-acetylogalaktozaminą oraz w niektórych unikalnych gangliozydach, glukozą. Mogą wystąpić poprzez wiązania N-glikozydowe lub O-glikozydowe.
funkcje
Uważa się, że kwasy sialowe pomagają organizmom pasożytniczym przetrwać w organizmie żywiciela; przykładami tego są ssacze patogeny, które wytwarzają enzymy metabolizmu kwasu sialowego (sialidazy lub liazy N-acetyloneuraminowe).
Nie ma gatunków ssaków, u których nie odnotowano obecności kwasów sialowych jako części ogólnie glikoprotein, glikoprotein surowicy, błony śluzowej, jako części struktur powierzchni komórek lub jako część węglowodanów złożonych.
Znaleziono je w kwaśnych oligosacharydach w mleku i siarze ludzi, bydła, owiec, psów i świń, a także w moczu szczurów i ludzi..
Rola w procesach adhezji komórek
Glikokoniugaty z częściami kwasu sialowego odgrywają ważną rolę w procesach wymiany informacji między sąsiednimi komórkami oraz między komórkami a ich środowiskiem..
Obecność kwasu sialowego w błonach komórkowych przyczynia się do powstania ujemnego ładunku na powierzchni, co ma pozytywne konsekwencje w niektórych zdarzeniach odpychania elektrostatycznego między komórkami a niektórymi cząsteczkami..
Ponadto ładunek ujemny nadaje kwasom sialowym w membranie funkcję transportu jonów naładowanych dodatnio..
Donoszono, że kwas sialowy ułatwia wiązanie śródbłonka i nabłonka z błoną podstawną kłębuszków nerkowych, co również wpływa na kontakt między tymi komórkami..
Rola w żywotności składników krwinek
Kwas sialowy pełni ważne funkcje jako część glikoforyny A w błonie komórkowej erytrocytów. Niektóre badania wykazały, że zawartość kwasu sialowego jest odwrotnie proporcjonalna do wieku tych komórek.
Erytrocyty poddane działaniu enzymów neuraminidazy, odpowiedzialnych za degradację kwasu sialowego, drastycznie zmniejszają ich okres półtrwania we krwi ze 120 dni do kilku godzin. Ten sam przypadek zaobserwowano w przypadku płytek krwi.
Trombocyty tracą zdolność adhezji i agregacji pod nieobecność kwasu sialowego w ich białkach powierzchniowych. W limfocytach kwas sialowy odgrywa również ważną rolę w procesach adhezji i rozpoznawania komórek, a także w interakcji z receptorami powierzchniowymi..
Funkcje w układzie odpornościowym
Układ odpornościowy jest w stanie rozróżnić swoje własne lub atakujące struktury na podstawie rozpoznania wzorców kwasu sialowego obecnych w błonach.
Kwas sialowy, a także enzymy neuraminidaza i sialilotransferaza posiadają ważne właściwości regulacyjne. Końcowe części kwasu sialowego w glikokoniugatach błony komórkowej pełnią funkcje maskowania lub jako receptory błonowe..
Ponadto różni autorzy podnieśli możliwość, że kwas sialowy ma funkcje antygenowe, ale nie jest to jeszcze znane z pewnością. Jednak funkcje maskujące reszt kwasu sialowego są bardzo ważne w regulacji komórkowej..
Maskowanie może odgrywać bezpośrednią lub pośrednią rolę ochronną, w zależności od tego, czy część kwasu sialowego bezpośrednio pokrywa antygenową resztę węglowodanową, czy też jest to kwas sialowy w sąsiednim glikokoniugacie, który maskuje część antygenową..
Niektóre przeciwciała posiadają reszty Neu5Ac, które wykazują właściwości neutralizujące wirusy, ponieważ te immunoglobuliny są zdolne do zapobiegania adhezji wirusów tylko do sprzężonych (glikokoniugatów z częściami kwasu sialowego) na błonie komórkowej.
Inne funkcje
W przewodzie pokarmowym równie ważną rolę odgrywają kwasy sialowe, wchodzące w skład mucyn, które mają istotne dla całego organizmu właściwości natłuszczające i ochronne..
Ponadto kwasy sialowe występują również w błonach komórek nabłonka oskrzeli, żołądka i jelit, gdzie biorą udział w transporcie, wydzielaniu i innych procesach metabolicznych..
Choroby
Wiadomo, że wiele chorób obejmuje nieprawidłowości w metabolizmie kwasu sialowego i są one znane jako sialidoza. Do najważniejszych należą sialuria i choroba Salli, które charakteryzują się wydalaniem z moczem z dużymi ilościami wolnych kwasów sialowych..
Inne choroby o podłożu immunologicznym mają związek ze zmianami enzymów anabolicznych i katabolicznych związanych z metabolizmem kwasu sialowego, które powodują nieprawidłową akumulację glikokoniugatów z częściami kwasu sialowego..
Znane są również choroby związane z czynnikami krwi, takie jak trombocytopenia polegająca na obniżeniu poziomu trombocytów we krwi, spowodowanym prawdopodobnie brakiem kwasu sialowego w błonie..
Choroba von Willebranda odpowiada zaburzeniu zdolności trombocytów do przylegania do glikokoniugatów błony śródbłonkowej ściany naczynia krwionośnego, spowodowanemu niedoborem lub niedoborem glikozylacji lub sialilacji.
Trombastenia Glanzmanna jest kolejnym wrodzonym zaburzeniem agregacji trombocytów, którego korzeniem jest obecność wadliwych glikoprotein w błonie trombocytów. Wykazano, że defekty tych glikoprotein są związane ze zmniejszoną zawartością Neu5Ac.
Bibliografia
- Clayden, J., Greeves, N., Warren, S. i Wothers, P. (2001). Chemia organiczna (1st ed.). Nowy Jork: Oxford University Press.
- Demchenko, A. V (2008). Handbook of Chemical Glycosylation: Advances in Stereoselectivity and Therapeutical Relevance. Wiley-VCH.
- Rosenberg, A. (1995). Biologia kwasów sialowych. Nowy Jork: Springer Science + Business Media, LLC.
- Schauer, R. (1982). Kwasy sialowe: chemia, metabolizm i funkcja. Springer-Verlag Wien Nowy Jork.
- Traving, C. i Schauer, R. (1998). Budowa, funkcja i metabolizm kwasów sialowych. CMLS Nauki o życiu komórkowym i molekularnym, 54, 1330-1349.



Jeszcze bez komentarzy