
Struktura, właściwości, synteza, zastosowania kwasu amidosulfonowego

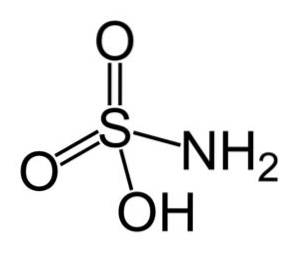
Plik kwas amidosulfonowy jest związkiem nieorganicznym utworzonym przez kowalencyjnie związany atom siarki (S) oraz wiązanie pojedyncze z grupą hydroksylową (-OH) i grupą aminową (-NHdwa) i przez podwójne wiązanie z dwoma atomami tlenu (O). Jest to biała krystaliczna substancja stała. Jego wzór chemiczny to NHdwapołudniowy zachód3H. Znany również jako kwas aminosulfonowy, kwas amidosulfonowy, kwas amidosulfonowy i kwas sulfamidowy..
Kwas amidosulfonowy to mocny kwas. Może reagować z metalami, tlenkami metali i węglanami. Jego sole są na ogół rozpuszczalne w wodzie, dzięki czemu dobrze usuwają kamień w urządzeniach procesowych. Jest często używany w cukrowniach do czyszczenia osadów węglanowych w sprzęcie wyparnym..
Kwas amidosulfonowy jest reduktorem azotynów (NOdwa-) i ta właściwość chemiczna jest wykorzystywana w różnych zastosowaniach, takich jak przemysł farbiarski i analiza azotynów..
Służy do garbowania skór i wybielania miazgi do produkcji papieru. W rzeczywistości jest to zanieczyszczenie żywności, ponieważ często znajduje się w papierze i tekturze używanych do pakowania artykułów spożywczych..
Stosowany jest również do elektroosadzania metali, jako standard laboratoryjny, a jedna z jego pochodnych jest bardzo skutecznym herbicydem..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3,6 pH
- 3.7 Stała dysocjacji
- 3.8 Właściwości chemiczne
- 3.9 Inne właściwości
- 4 Synteza
- 5 zastosowań
- 5.1 W przemyśle farbiarskim
- 5.2 W obróbce skóry
- 5.3 W urządzeniach do czyszczenia
- 5.4 W rafinacji metali
- 5.5 Jako standardowy odczynnik w laboratorium
- 5.6 W analizie azotynów
- 5.7 W analizie tlenu rozpuszczonego w wodzie
- 5.8 Przy przygotowywaniu podtlenku azotu
- 5.9 W rolnictwie
- 5.10 Na tkaninach ognioodpornych
- 5.11 W różnych zastosowaniach
- 6 Odnośniki
Struktura
Kwas amidosulfonowy krystalizuje w postaci dipiramidowych kryształów rombowych. Tworzy zwarte graniastosłupy i arkusze podczas krystalizacji z zimnego roztworu, a także arkusze diamentowe podczas krystalizacji z gorącego roztworu wodnego.
Nomenklatura
- Kwas amidosulfonowy
- Kwas aminosulfonowy
- Kwas amidosulfonowy
- Kwas amidosiarkowy
- Kwas sulfamidowy
Nieruchomości
Stan fizyczny
Białe krystaliczne ciało stałe.
Waga molekularna
97,1 g / mol.
Temperatura topnienia
205 ºC, rozkłada się w temperaturze 209 ºC.
Gęstość
2,15 g / cm3
Rozpuszczalność
Rozpuszczalny w wodzie:
- 12,8% przy 0 ºC
- 17,57% przy 20 ºC
- 22,77% przy 40 ºC
Słabo rozpuszczalny w metanolu, słabo rozpuszczalny w acetonie, nierozpuszczalny w eterze.
Dobrze rozpuszczalny w zasadach azotowych i rozpuszczalnikach organicznych zawierających azot.
Nierozpuszczalny w dwusiarczku węgla (CSdwa) i czterochlorek węgla (CCl4).
pH
0,41 (w roztworze 1 N, czyli 1 równoważnik / l).
Stała dysocjacji
0,101 w 25 ° C.
Właściwości chemiczne
To mocny kwas. Prawie tyle samo co kwas solny (HCl), azotowy (HNO3) i siarkowy (H.dwapołudniowy zachód4).
Wodne roztwory kwasu amidosulfonowego są silnie zjonizowane. Jego pH jest niższe niż roztworów kwasu mrówkowego, fosforowego i szczawiowego.
W wodzie kwas amidosulfonowy traci tylko proton związany z tlenem. Wodory związane z azotem ściśle trzymają się razem.
W roztworze wodnym hydrolizuje powoli, dając kwaśny siarczan amonu (NH4HSO4). Jest stabilny w suchych warunkach.
Kwas amidosulfonowy atakuje metale, tlenki metali i węglany, tworząc sulfaminiany. Na przykład z metalicznym potasem (K) tworzy siarczan potasu (KOSOdwaNHdwa) i wodór (H.dwa).
Wszystkie sole kwasu amidosulfonowego są rozpuszczalne w wodzie. Sole wapnia, ołowiu i baru są bardzo dobrze rozpuszczalne w wodzie, w przeciwieństwie do odpowiednich soli kwasu siarkowego.
Kwas azotowy (HNOdwa) reaguje ilościowo z grupą aminową kwasu amidosulfonowego, uwalniając azot (Ndwa). Ocenia się, że jon sulfaminianowy działa w tej reakcji jako amid, a nie amina..
Kwas amidosulfonowy jest utleniany przez chlor, brom lub chloran potasu, aby przekształcić go w kwas siarkowy. Ta reakcja nie zachodzi w przypadku innych utleniaczy, takich jak kwas chromowy lub nadmanganian potasu..
Nie jest kompatybilny (reaguje) z silnymi alkaliami, chlorem, kwasem podchlorawym, podchlorynami, cyjankami i siarczkami.
Inne właściwości
Nie jest higroskopijny (oznacza to, że nie pochłania wilgoci z powietrza).
Po podgrzaniu do rozkładu wydziela wysoce toksyczne opary tlenków siarki i chlorowodoru (HCl).
Jedna z jego pochodnych, sulfaminian amonu, jest środkiem zmniejszającym palność.
Jest umiarkowanie toksyczny.
Synteza
Kwas amidosulfonowy otrzymuje się w reakcji mocznika CO (NHdwa)dwa z dymiącym kwasem siarkowym, czyli kwasem siarkowym (H.dwapołudniowy zachód4) koncentrat zawierający trójtlenek siarki (SO3).
Można go również syntetyzować w reakcji kwasu chlorosulfonowego (HClO3Cl) i amoniak (NH3).
Aplikacje
W przemyśle farbiarskim
Kwas amidosulfonowy służy do szybkiego i skutecznego usuwania nadmiaru azotynów w reakcjach diazowania w syntezie barwników. W tym celu jest znacznie bardziej praktyczny niż mocznik.
W obróbce skóry
Podczas garbowania skóry użycie kwasu amidosulfonowego zamiast kwasu siarkowego zapewnia delikatniejszą i jedwabistą teksturę.
Ponadto, ponieważ sulfaminian wapnia jest rozpuszczalny w wodzie, w przeciwieństwie do siarczanu wapnia, kwas amidosulfonowy może być stosowany w procesie odwapniania bez pozostawiania plam, które czasami pojawiają się na skórze podczas stosowania kwasu siarkowego..

W urządzeniach do czyszczenia
Kwas amidosulfonowy jest stosowany jako środek do usuwania kamienia w kotłach, reaktorach, rurach, układach chłodzenia i wymiennikach ciepła.
W urządzeniach tych inkrustacje powstają w wyniku cyrkulacji wody lub związków procesowych w elektrowniach, zakładach chemicznych, hutach, papierniach, tłoczniach i innych gałęziach przemysłu..
Kamień lub osady stałe mogą być organiczne (algi, muł, grzyby) lub nieorganiczne (tlenki żelaza, siarczki żelaza, węglany, siarczany, fosforany lub krzemiany wapnia lub magnezu).
Kwas amidosulfonowy jest bardzo skuteczny w usuwaniu kamienia z węglanu wapnia. Może być stosowany na sprzęcie z miedzi, mosiądzu, stali nierdzewnej, żeliwa i stali ocynkowanej.
Stosowany jest w postaci 5-10% roztworu wagowego. Znajduje zastosowanie zwłaszcza w cukrowniach do czyszczenia żeliwnych parowników z miedzianymi wymiennikami ciepła.

Powinien być stosowany w temperaturach nie wyższych niż 50-60 ºC. Temperatury 70 ºC prowadzą do tworzenia nierozpuszczalnych siarczanów, takich jak CaSO4.
W połączeniu z chlorkiem sodu występuje efekt synergistyczny, a roztwór pozwala na powolne rozpuszczanie tlenku żelaza. W takim przypadku nie należy go stosować do stali nierdzewnej, ponieważ wydziela się kwas solny, który może powodować korozję tego materiału..
W rafinacji metali
Galwanizacja takich metali jak miedź, srebro, kobalt, nikiel, cynk, kadm, żelazo i ołów można z powodzeniem przeprowadzić w roztworach kwasu amidosulfonowego. Można to zrobić znacznie łatwiej niż kwas hydrofluorokrzemowy (H.dwaSiF6).
Jako standardowy odczynnik w laboratorium
Biorąc pod uwagę pewne cechy kwasu amidosulfonowego, takie jak: moc kwasu, łatwość oczyszczania przez rekrystalizację w wodzie, stabilność i niehigroskopijność, został on wykorzystany jako podstawowy standard na poziomie laboratoryjnym. Oznacza to, że jest używany do ilościowego oznaczania alkaliów..

W analizie azotynów
Ze względu na łatwą reakcję z azotynami, do ich oznaczania w roztworze stosuje się kwas amidosulfonowy..
W analizie tlenu rozpuszczonego w wodzie
Ponieważ kwas amidosulfonowy reaguje z azotynami w wodzie, uwalniany jest azot, możliwe jest oznaczanie tlenu rozpuszczonego w wodzie, ponieważ eliminowane są zakłócenia powodowane przez azotyny..
W przygotowaniu podtlenku azotu
Kwas amidosulfonowy reaguje z kwasem azotowym, tworząc podtlenek azotu (NdwaLUB). Ta reakcja jest bezpieczniejsza niż w przypadku azotanu amonu w celu uzyskania tego gazu.
W rolnictwie
Pochodna kwasu amonowego, sulfaminian amonu, jest skutecznym nietoksycznym herbicydem dla zwierząt.
Stosuje się go przez rosę na liście gatunku, który ma być usunięty pod koniec lata lub wczesną jesienią, najlepiej przy wilgotnej pogodzie. Gdy związek przemieszcza się z liści do korzeni, roślina umiera.

Kolejną zaletą tego związku jest to, że nie sterylizuje trwale gleby. Rzeczywiście, część azotu z sulfaminianu amonu będzie dostępna w glebie do wzrostu roślin w następnym sezonie..
W tkaninach ognioodpornych
Jego kompatybilność z celulozą i właściwości ognioodporne sprawiają, że amonosulfaminian jest środkiem do otrzymywania ognioodpornych tkanin i papieru..
Wykorzystywana jest do 10% wagi tkaniny, której wygląd i dotyk pozostają niezmienione. W trakcie użytkowania tkaninę należy czyścić chemicznie, nigdy nie myć wodą, aby nie rozpuścić sulfaminianu.
Jest szczególnie przydatny w zasłonach teatralnych lub podobnych miejscach.

W różnych zastosowaniach
Jest stosowany jako katalizator w niektórych reakcjach chemicznych, np. Przy wytwarzaniu żywic mocznikowo-formaldehydowych. Jest również przydatny jako środek bakteriobójczy i stabilizator chloru w basenach oraz jako wybielacz ścieru drzewnego w celulozowniach i papierniach..
Bibliografia
- NAS. National Library of Medicine. (2019). Kwas amidosulfonowy. Odzyskany z pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrozacja w centrach azotowych. W reakcjach nitrozowania i chemii tlenku azotu. Rozdział 2. Odzyskany z sciencedirect.com
- Clapp, Leallyn B. (1943). Kwas amidosulfonowy i jego zastosowania. Chem. Educ. 1943, 20, 4, 189. Odzyskane z pubs.acs.org
- McDonald, James. (2003). Kwas amidosulfonowy. Odzyskany z veoliawatertech.com
- Sastri, V.S. (2010). Zarządzanie i kontrola korozji. W korozji Shreira. Odzyskany z sciencedirect.com
- Pratima Bajpai. (2018). Różne tematy. W Handbook of Pulp and Paper Biermanna. Trzecia edycja. Odzyskany z sciencedirect.com



Jeszcze bez komentarzy