
Struktura, zastosowania, otrzymywanie, zagrożenia, właściwości dwutlenku chloru (ClO2)

Plik dwutlenek chloru Jest to związek nieorganiczny utworzony przez pierwiastek chloru (Cl) i tlenu (O). Jego wzór chemiczny to ClOdwa. Jest to gaz od zielonkawożółtego do czerwonawego. Nie występuje naturalnie w środowisku.
Jest niezwykle reaktywny, dlatego często przygotowuje się go tam, gdzie ma być użyty. Jednym z jego najważniejszych zastosowań jest środek bakteriobójczy, antyseptyczny i dezodoryzujący, ponieważ bardzo łatwo i w bardzo małych stężeniach eliminuje bakterie, wirusy i grzyby..

Umożliwia dezynfekcję żywności, takiej jak warzywa, owoce, mięso, drób i owoce morza. Służy do odkażania powierzchni, podłóg, łazienek, systemów wentylacyjnych, basenów, sprzętu laboratoryjnego, sprzętu dentystycznego itp..
Z tego powodu znajduje zastosowanie w przetwórstwie spożywczym, w szpitalach i klinikach, w przemyśle i sklepach. Służy do oczyszczania wody pitnej i ścieków komunalnych.
Jest bardzo skuteczny jako utleniacz, dlatego służy m.in. do wybielania masy papierniczej, olejów, mąki, skóry, włókien tekstylnych..
Gdy występuje w postaci gazu, jest bardzo niebezpieczny, ponieważ jest silnie wybuchowy i jest stosowany głównie w roztworach wodnych. Działa toksycznie w przypadku wdychania.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 3.7 Właściwości chemiczne
- 3.8 Właściwości jej roztworów wodnych
- 3.9 Inne właściwości
- 4 Otrzymywanie
- 5 Stosuje się jako środek dezynfekujący
- 5.1 W żywności
- 5.2 Na papierze i tekturze, które będą miały kontakt z żywnością
- 5.3 W wodzie pitnej
- 5.4 W stomatologii
- 5.5 W zastosowaniach medycznych
- 6 Inne zastosowania
- 7 Ryzyka
- 8 Odniesienia
Struktura
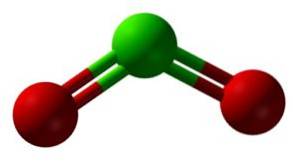
Dwutlenek chloru powstaje w wyniku połączenia atomu chloru (Cl) z dwoma atomami tlenu (O). Wiązania chloru z każdym tlenem są kowalencyjne i podwójne. Chlor w tym związku ma wartościowość +4.
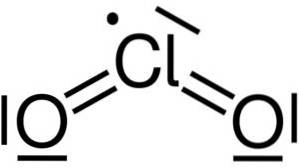
Ma symetryczną i pochyloną strukturę, ponieważ ma wolne elektrony. Oznacza to, że nie tworzą wiązania z żadnym innym atomem.
Nomenklatura
- Dwutlenek chloru
- Tlenek chloru (IV)
Nieruchomości
Stan fizyczny
Gaz zielonkawo-żółty do czerwonawo-żółtego.
Waga molekularna
67,45 g / mol.
Temperatura topnienia
-59 ºC.
Temperatura wrzenia
11 ºC.
Gęstość
Ciecz w 0 ° C = 1,642 g / cm3
Gaz = 2,33 (gęstość względna w stosunku do powietrza, powietrze = 1).
Rozpuszczalność
Rozpuszczalny w wodzie: 2000 cm3 ClOdwa gaz w 100 cm3 zimnej wody lub 0,8 g / 100 ml wody o temperaturze 20 ° C. Rozpuszczalny w roztworze zasadowym i roztworze kwasu siarkowego H.dwapołudniowy zachód4.
Właściwości chemiczne
ClOdwa jest niezwykle reaktywny i może gwałtownie eksplodować. Jest bardzo skutecznym środkiem utleniającym.
ClOdwa rozkłada się gwałtownie w kontakcie z materiałami organicznymi. Jeśli znajduje się w powietrzu o stężeniu większym niż 10%, może eksplodować pod wpływem światła słonecznego lub ciepła.
Może również wybuchać w obecności rtęci (Hg) lub tlenku węgla (CO).
Pod wpływem światła ultrafioletowego (UV) lub ozonu, ClOdwa staje się heksatlenkiem chloru CldwaLUB6, bardzo niestabilny związek.
Właściwości twoich wodnych roztworów
Jego wodne roztwory są żółte lub czerwonawo-żółte. Są stabilne, jeśli są przechowywane w chłodnym miejscu, dobrze uszczelnione i chronione przed światłem słonecznym. W obecności światła roztwory te powoli rozkładają się, dając kwas solny HCl i kwas chlorowy HClO.3.

W roztworach alkalicznych ClOdwa rozkłada się na jony chlorynowe ClOdwa- i Chloran ClO3-. HClO kwasu chlorawego tworzy się w roztworach kwaśnychdwa a następnie rozkłada się do kwasu solnego HCl i kwasu chlorowego HClO3.
Inne właściwości
Skoncentrowane opary ClOdwa są potencjalnie wybuchowe, więc nie było możliwe ich sprężenie samodzielnie lub zmieszane z innymi gazami. Z tego powodu najlepiej jest przygotować go na miejscu, w którym będzie używany..
Kiedy jest w bardzo niskich temperaturach w swojej uwodnionej postaci, co czasami jest sposobem, w jaki jest przenoszona, ma kształt bryły przypominającej lód i ma kolor pomarańczowy..
Ma zapach podobny do chloru. Działa toksycznie przez drogi oddechowe.
Otrzymywanie
Można go zdobyć na kilka sposobów. Na przykład w niektórych przypadkach rozwiązania ClOdwa są przygotowywane przez przepuszczenie mieszaniny gazowego chloru (Cldwa) i powietrze (lub chlor gazowy i azot Ndwa) przez kolumnę zawierającą granulki chlorynu sodu (NaClOdwa).
2 NaClOdwa + Cldwa → 2 NaCl + 2 ClOdwa
Wygenerowany produkt zawiera około 90% ClOdwa, wśród innych związków chloru.
Otrzymywany jest również z chloranu potasu (KClO3) i kwas siarkowy (H.dwapołudniowy zachód4) w obecności kwasu szczawiowego jako środka redukującego. W tym przypadku dwutlenek węgla (COdwa) używany do rozcieńczania ClOdwa.
Można go przygotować na miejscu użycia, zaczynając od chloranu sodu (NaClO3), kwas siarkowy (H.dwapołudniowy zachód4) i metanol (CH3O).
W przemyśle otrzymywany jest z chloranu sodu (NaClO3) i dwutlenek siarki (SOdwa) w obecności kwasu siarkowego.
2 NaClO3 + południowy zachóddwa + H.dwapołudniowy zachód4 → 2 ClOdwa + 2 NaHSO4
Używany jako środek dezynfekujący
Może być stosowany jako silny środek przeciwbakteryjny. Stwierdzono, że jest wysoce skuteczny przeciwko różnym mikroorganizmom, takim jak Escherichia coli i Staphylococcus aureus.
W przypadku tego ostatniego wystarczy stężenie tylko 5 ppm ClOdwa wyeliminować 100% z nich. Działa bakteriobójczo, antyseptycznie i dezodoryzująco. Jest skuteczny w szerokim zakresie pH.
W jedzeniu
Jest stosowany jako środek przeciwdrobnoustrojowy w wodzie do odkażania owoców i warzyw, w przetwórstwie drobiu, czerwonego mięsa, zarówno kawałków mięsa, jak i narządów oraz produktów morskich, takich jak skorupiaki..

Roztwory dwutlenku chloru należy stosować w stężeniu nieprzekraczającym 3 ppm (części na milion) ClOdwa pozostałości, aby nie miały wpływu na żywność.
Po zabiegu ClOdwa cała żywność musi być dokładnie wypłukana wodą pitną lub przeznaczona do blanszowania, gotowania lub konserwowania.
W przypadku produktów morskich rozwiązanie ClOdwa Powinien być stosowany w wodzie i lodzie używanym do płukania, mycia, rozmrażania, transportu lub przechowywania. Surowe skorupiaki należy następnie dokładnie umyć wodą pitną przed spożyciem..

Na papierze i tekturze, które będą miały kontakt z żywnością
Rozwiązania ClOdwa służą do eliminacji mikroorganizmów powodujących szlam (takich jak glony, bakterie i grzyby) w wodzie technologicznej używanej do produkcji papieru i tektury, które będą miały kontakt z żywnością.
W wodzie pitnej
Służy do oczyszczania wody i nadawania jej do picia (zdatny do picia). Służy do wstępnej obróbki wody, która będzie później butelkowana do picia lub wody, która będzie używana jako składnik do produkcji napojów lub napojów bezalkoholowych..

W stomatologii
Znajduje zastosowanie w instrumentach używanych przez dentystę lub dentystę do ich dezynfekcji i niszczenia znajdujących się w nich organizmów chorobotwórczych.
W zastosowaniach medycznych
Wodne roztwory ClOdwa były stosowane w leczeniu zakażeń drożdżakowych jamy ustnej (zakażenia jamy ustnej). Kandydoza to infekcja wywołana przez grzyby Candida albicans.
Dwutlenek chloru zabija grzyby jamy ustnej i znacznie poprawia wygląd tkanek jamy ustnej bez skutków ubocznych.
Niektórzy badacze medyczni wskazują, że rozwiązania ClOdwa zastosowany na rany po operacjach chirurgicznych może zmniejszyć lub zahamować tworzenie się zrostów bez wpływu na jego gojenie, z dodatkową zaletą właściwości antyseptycznych.
Inne zastosowania
Ze względu na swoje właściwości utleniające i bakteriobójcze ClOdwa jest używany do:
- Wybiela miazgę z drewna w produkcji masy celulozowej i papieru, zapewniając stabilny połysk.
- Tłuszcze i oleje wybielające, skóra, mąka wybielająca i tekstylia.
- Zastosowania rolnicze, takie jak dezynfekcja twardych powierzchni, sprzętu, systemów wodnych i szklarni na grzyby.
- Zastosowania w przemyśle, sklepach i szpitalach np. Dezynfekcja twardych powierzchni (ściany, podłogi, łazienki), systemy wentylacyjne, sprzęt laboratoryjny.
- Dezynfekuj podłogi i łazienki w domach, systemy klimatyzacji, systemy cyrkulacji wody basenowej.
- Oczyszczanie ścieków komunalnych i przemysłowych.
- Usuwanie zanieczyszczeń na polach naftowych.
- Produkcja soli chlorkowych (Cl-).
Ryzyka
- Skoncentrowane opary ClOdwa są potencjalnie wybuchowe.
- Działa toksycznie przez drogi oddechowe i po spożyciu. Działa drażniąco na oczy, nos i gardło, może powodować obrzęk płuc i przewlekłe zapalenie oskrzeli.
- Według konsultowanych źródeł ClOdwa nie powoduje mutacji DNA ani raka u ludzi.
Bibliografia
- NAS. National Library of Medicine. (2019). Dwutlenek chloru. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Dean, J.A. (redaktor). (1973). Lange's Handbook of Chemistry (wydanie jedenaste). McGraw-Hill Book Company.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Bajpai, P. (2012). Wybielanie dwutlenkiem chloru. Wpływ wybielania dwutlenkiem chloru na jakość masy celulozowej. W ekologicznie łagodnych podejściach do wybielania masy celulozowej (wydanie drugie). Odzyskany z sciencedirect.com.
- Moran, S. (2018). Chemia wody. Dwutlenek chloru. W stosowanym przewodniku po projektowaniu oczyszczalni wody i ścieków. Odzyskany z sciencedirect.com.
- McKeen, L. (2012). Wprowadzenie do napromieniania żywności i sterylizacji medycznej. Gazowy dwutlenek chloru. W efekcie sterylizacji tworzyw sztucznych i elastomerów (wydanie trzecie). Odzyskany z sciencedirect.com.

Jeszcze bez komentarzy