
Struktura węglanu potasu (K2CO3), właściwości, zastosowanie, produkcja

Plik Weglan potasu jest związkiem nieorganicznym utworzonym przez dwa jony potasu K.+ i jon węglanowy CO3dwa-. Jego wzór chemiczny to K.dwaWSPÓŁ3. Jest higroskopijną białą substancją stałą, czyli łatwo absorbuje wodę z otoczenia. Z tego powodu w laboratoriach służy do wchłaniania wody z innych substancji..
Jest bardzo dobrze rozpuszczalny w wodzie, tworząc roztwory zasadowe, które są bogate w jony OH.-a zatem o wysokiej wartości pH. Jej wodne roztwory, jako alkaliczne, są wykorzystywane w różnych procesach przemysłowych do pochłaniania kwaśnych gazów, takich jak dwutlenek węgla COdwa i siarkowodór H.dwaTak, łatwo je neutralizuje.

KdwaWSPÓŁ3 Służy do przygotowania mydeł, środków czystości, środków piorących i mieszanek do mycia naczyń. Jest również używany do przetwarzania niektórych włókien tekstylnych, takich jak wełna..
Znajduje szerokie zastosowanie w laboratoriach chemicznych, np. Do pochłaniania wody z innych związków lub alkalizowania mieszanin reakcji chemicznych, a także w analizie chemicznej.
Jest również dodawany do niektórych produktów spożywczych, na przykład w celu wyeliminowania gorzkiego smaku ziaren kakaowych podczas produkcji czekolady..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 3,7 pH
- 3.8 Właściwości chemiczne
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 W pochłanianiu CO2 w procesach przemysłowych
- 5.2 W usuwaniu H2S z niektórych procesów
- 5.3 W laboratoriach chemicznych
- 5.4 W branży środków czystości
- 5.5 W przemyśle spożywczym
- 5.6 W nawozach
- 5.7 W różnych zastosowaniach
- 6 Odnośniki
Struktura
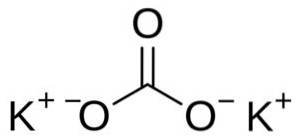
Węglan potasu składa się z dwóch kationów potasowych K.+ i anion węglanowy CO3dwa-. Anion węglanowy ma płaską i symetryczną strukturę, podczas gdy trzy atomy tlenu otaczają węgiel tworząc płaski trójkąt..
Nomenklatura
- Weglan potasu
- Weglan potasu
- Węglan dipotasowy
- Potaż
- Sól potasowa kwasu węglowego.
Nieruchomości
Stan fizyczny
Bezbarwna do białej krystalicznej substancji stałej.
Waga molekularna
138,205 g / mol.
Temperatura topnienia
899 ºC.
Temperatura wrzenia
Rozkłada się.
Gęstość
2,29 g / cm3
Rozpuszczalność
Bardzo dobrze rozpuszczalny w wodzie: 111 g / 100 g wody o temp. 25 ° C. Nierozpuszczalny w etanolu i acetonie.
pH
Wodny roztwór może mieć pH 11,6, to znaczy jest dość zasadowy.
Właściwości chemiczne
Węglan potasu jest rozpuszczalny lub higroskopijny, to znaczy pochłania wilgoć z otoczenia. Posiada stabilny hydrat, KdwaWSPÓŁ3.2HdwaLUB.
KdwaWSPÓŁ3 w roztworze wodnym hydrolizuje, czyli reaguje z wodą uwalniając grupy OH- które są tymi, które nadają zasadowość roztworom:
WSPÓŁ3dwa- + H.dwaO ⇔ OH- + HCO3-
HCO3- + H.dwaO ⇔ OH- + H.dwaWSPÓŁ3
Otrzymywanie
Można go uzyskać z popiołów, które pozostają podczas spalania roślin. Również przez karbonatyzację wodorotlenku potasu KOH, czyli dodanie nadmiaru dwutlenku węgla COdwa do KOH:
KOH + COdwa → KHCO3
2 KHCO3 + ciepło → KdwaWSPÓŁ3 + H.dwaLUB
Innym sposobem jego uzyskania jest ogrzewanie chlorku potasu KCl z węglanem magnezu MgCO3, woda i COdwa pod presją. W pierwszej kolejności otrzymuje się uwodnioną sól podwójną magnezu i potasu MgCO3.KHCO3.4HdwaLub, zwana solą Engelsa:
2 KCl + 3 MgCO3 + WSPÓŁdwa + 5 godzdwaO → MgCO3.KHCO3.4HdwaO ↓ + MgCldwa
Uwodniona sól podwójna Engelsa wytrąca się i jest odfiltrowywana z roztworu. Następnie jest podgrzewany i powstaje węglan potasu K.dwaWSPÓŁ3 że po dodaniu wody rozpuszcza się natomiast węglan magnezu MgCO3 pozostaje nierozpuszczalny i jest usuwany przez filtrację.
MgCO3.KHCO3.4HdwaO + ciepło → MgCO3↓ + 2K+ + WSPÓŁ3dwa- + WSPÓŁdwa↑ + 9 H.dwaLUB
Aplikacje
W absorpcji COdwa w procesach przemysłowych
Roztwór węglanu potasu to klasyczna metoda usuwania dwutlenku węgla COdwa w różnych procesach, zwłaszcza w zastosowaniach wysokociśnieniowych i wysokotemperaturowych.

Usuwanie COdwa zachodzi zgodnie z następującą reakcją:
K.dwaWSPÓŁ3 + WSPÓŁdwa + H.dwaO ⇔ 2 KHCO3
Ta metoda jest stosowana na przykład do oczyszczania gazu ziemnego. Również w elektrowniach, aby uniknąć emisji COdwa do atmosfery i przy produkcji suchego lodu.

Rozwiązanie K.dwaWSPÓŁ3 można regenerować termicznie, czyli podgrzać do temperatury około 100 ° C.
Aby roztwór węglanu potasu mógł absorbować CO2 z dobrą prędkością, dodaje się promotory, które przyspieszają proces, takie jak dietanoloamina (DEA)..
Podczas usuwania H.dwaS niektórych procesów
Roztwory węglanu potasu są również używane do usuwania gazowego siarkowodoru H.dwaS dla strumieni procesowych. Czasami dodaje się potasowy trójfosforan potasowy3PO4 aby przyspieszyć proces.
W laboratoriach chemicznych
KdwaWSPÓŁ3 Pozwala na przeprowadzanie syntez organicznych, np. W reakcjach kondensacji oraz na neutralizację. Służy do usuwania wody z cieczy organicznych, jako środek odwadniający lub osuszający w laboratorium.
Znajduje również zastosowanie w analitycznych reakcjach chemicznych oraz do alkalizacji w przemyśle farmaceutycznym..
W branży środków czystości
KdwaWSPÓŁ3 Służy do produkcji mydeł, preparatów czyszczących, środków do prania i zmywania naczyń, a także do przygotowania szamponów i innych środków higieny osobistej.

W przemyśle spożywczym
Węglan potasu jest dodawany do różnych produktów spożywczych w różnych celach.
Na przykład dodaje się go do ziaren kakaowych w celu usunięcia gorzkiego smaku i wykorzystania do produkcji czekolady. Dodawany jest do winogron w procesie suszenia w celu uzyskania rodzynek.

W ciastach jest używany jako środek spulchniający (który działa jak drożdże) do mąki do przygotowania wypieków..

W nawozach
KdwaWSPÓŁ3 Służy do nawożenia gleb kwaśnych, ponieważ jon węglanowy CO3dwa- w kontakcie z wodą wytwarza jony OH- które zwiększają pH gleby. Plus potas K.+ jest pożywką dla roślin.
Węglan potasu był również używany do produkcji nawozów o spowolnionym działaniu.
Nawóz o spowolnionym działaniu uwalnia lub uwalnia składniki odżywcze powoli, dzięki czemu nie są one rozpuszczane i wymywane. Dzięki temu będą mogły spędzić więcej czasu dostępnego dla korzeni rośliny.
W różnych zastosowaniach
Węglan potasu K.dwaWSPÓŁ3 służy również do:
- Procesy barwienia, bielenia i czyszczenia surowej wełny oraz pozostała działalność przemysłu włókienniczego
- Otrzymywanie innych organicznych i nieorganicznych soli potasowych, takich jak cyjanek potasu KCN.
- Działa jako regulator kwasowości w różnych procesach.
- Wykonywanie ceramiki i garncarstwa.
- Procesy grawerowania i litografii.
- Garbowanie i wykańczanie skór.
- Przygotuj tusze do druku, pigmenty.
- Produkuje okulary specjalnie dla telewizji, od KdwaWSPÓŁ3 jest bardziej kompatybilny niż węglan sodu NadwaWSPÓŁ3 z tlenkami ołowiu, baru i strontu zawartymi w tych szkłach.
- Uzdatnianie wody.
- Ognioodporny (w postaci roztworów wodnych).
- Hamuje korozję i jako środek przeciwporostowy w urządzeniach procesowych.
Bibliografia
- NAS. National Library of Medicine. (2019). Weglan potasu. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). Chemia pierwiastków metalicznych. Pergamon Press Ltd. Londyn.
- Mokhatab, S. i in. (2019). Uzdatnianie gazu ziemnego. Roztwór węglanu potasu. W Handbook of Natural Gas Transmission and Processing (wydanie czwarte). Odzyskany z sciencedirect.com.
- Kakaras, E. i in. (2012). Układy kombinowane ze spalaniem w złożu fluidalnym pod ciśnieniem (PFBC). Spalanie w złożu fluidalnym pod ciśnieniem z wychwytywaniem i składowaniem dwutlenku węgla. W systemach o cyklu kombinowanym do wytwarzania energii o prawie zerowej emisji. Odzyskany z sciencedirect.com.
- Speight, J.G. (2019). Produkcja wodoru. Szorowanie na mokro. W odzyskiwaniu i ulepszaniu oleju ciężkiego. Odzyskany z sciencedirect.com.
- Branan, C.R. (2005). Obróbka gazów: Rozdział zaktualizowany przez Chrisa Higmana. Gorące procesy węglanowe. W praktycznych zasadach dla inżynierów chemików (wydanie czwarte). Odzyskany z sciencedirect.com.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. VCH Verlagsgesellschaft mbH.
- Li, Y. i Cheng, F. (2016). Synteza nowego nawozu potasowego o powolnym uwalnianiu ze zmodyfikowanego żużla magnezowego Pidgeon przez węglan potasu. J Air Waste Manag Assoc, 2016 sierpień; 66 (8): 758–67. Odzyskany z ncbi.nlm.nih.gov.


Jeszcze bez komentarzy