
Charakterystyka i przykłady kwasów

Plik kwasy są to związki o dużej skłonności do oddawania protonów lub przyjmowania pary elektronów. Istnieje wiele definicji (Bronsted, Arrhenius, Lewis) charakteryzujących właściwości kwasów, a każda z nich jest uzupełniona, aby zbudować globalny obraz tego typu związków..
Z powyższej perspektywy wszystkie znane substancje mogą być kwaśne, jednak tylko te, które wyróżniają się znacznie powyżej innych, są za takie uważane. Innymi słowy: jeśli substancja jest wyjątkowo słabym donorem protonów w porównaniu np. Z wodą, to można powiedzieć, że nie jest to kwas.

W takim przypadku, jakie dokładnie są kwasy i ich naturalne źródła? Typowy ich przykład można znaleźć w wielu owocach, np. Cytrusach. Lemoniady mają swój charakterystyczny smak dzięki kwaskowi cytrynowemu i innym składnikom.
Język może wykryć obecność kwasów, tak jak w przypadku innych smaków. W zależności od poziomu kwasowości tych związków smak staje się bardziej nie do zniesienia. W ten sposób język działa jako organoleptyczny miernik stężenia kwasów, a zwłaszcza stężenia jonów hydroniowych (H3LUB+).
Z drugiej strony kwasy znajdują się nie tylko w żywności, ale także w organizmach żywych. Podobnie gleby zawierają substancje, które mogą je scharakteryzować jako kwaśne; tak jest w przypadku aluminium i innych kationów metali.
Indeks artykułów
- 1 Charakterystyka kwasów
- 1.1 - Właściwości fizyczne
- 1.2 - Zdolność do generowania protonów
- 1.3 - Mają wodory o niskiej gęstości elektronowej
- 1.4 - Stała wytrzymałości lub kwasowości
- 1.5 - Ma bardzo stabilne zasady koniugatu
- 1.6 - Mogą mieć ładunki dodatnie
- 1.7 - Twoje roztwory mają wartości pH niższe niż 7
- 1.8 - Zdolność do neutralizacji zasad
- 2 Mocne kwasy i słabe kwasy
- 3 Przykłady kwasów
- 3.1 Halogenowodory
- 3.2 Oksokwasy
- 3.3 Super kwasy
- 3.4 Kwasy organiczne
- 4 Odnośniki
Charakterystyka kwasów
Jakie cechy musi mieć związek, zgodnie z istniejącymi definicjami, aby można go było uznać za kwaśny??
Musi być w stanie generować jony H.+ i OH- rozpuszczając się w wodzie (Arrhenius), musi bardzo łatwo przekazywać protony innym gatunkom (Bronsted) lub ostatecznie musi być w stanie przyjąć parę elektronów, ładując się ujemnie (Lewis).
Jednak te cechy są ściśle związane ze strukturą chemiczną. Dlatego ucząc się go analizować, można wywnioskować siłę jego kwasowości lub kilku związków, który z nich jest najbardziej kwaśny..
- Właściwości fizyczne
Kwasy mają smak warty zbędności, kwaśny, a ich zapach często pali nozdrza. Są to płyny o lepkiej lub oleistej konsystencji, które mają zdolność zmiany koloru papieru lakmusowego i oranżu metylowego na czerwony (Properties of Acids and Bases, S.F.).
- Zdolność do generowania protonów
W 1923 roku duński chemik Johannes Nicolaus Brønsted i angielski chemik Thomas Martin Lowry przedstawili teorię Brønsteda i Lowry'ego, stwierdzając, że każdy związek, który może przenieść proton do dowolnego innego związku, jest kwasem (Encyclopædia Britannica, 1998). Na przykład w przypadku kwasu solnego:
HCl → H+ + Cl-
Teoria Brønsteda i Lowry'ego nie wyjaśniła kwaśnego zachowania niektórych substancji. W 1923 roku amerykański chemik Gilbert N. Lewis przedstawił swoją teorię, w której kwas uważany jest za każdy związek, który w reakcji chemicznej jest zdolny do połączenia pary elektronów niedzielonych w innej cząsteczce (Encyclopædia Britannica, 1998).
W ten sposób jony takie jak Cudwa+, wiaradwa+ i wiarę3+ Posiadają zdolność wiązania się z parami wolnych elektronów np. Z wody do produkcji protonów w sposób:
Cudwa+ + 2HdwaO → Cu (OH)dwa + 2H+
- Zawierają wodory o niskiej gęstości elektronowej
Dla cząsteczki metanu, CH4, żaden z jego wodorów nie jest pozbawiony elektronów. Dzieje się tak, ponieważ różnica elektroujemności między węglem a wodorem jest bardzo mała. Ale gdyby jeden z atomów H został zastąpiony jednym z atomów fluoru, wówczas nastąpiłaby zauważalna zmiana w momencie dipolowym: HdwaFC-H..
H. doświadcza przemieszczenia swojej chmury elektronów w kierunku sąsiedniego atomu związanego z F, co jest takie samo, δ + wzrasta. Ponownie, jeśli inny H zostanie zastąpiony innym F, wówczas cząsteczka będzie wyglądać następująco: HFdwado-H..
Teraz δ + jest jeszcze wyższy, ponieważ są to dwa silnie elektroujemne atomy F, które odejmują gęstość elektronów od C, a ten ostatni, w konsekwencji, od C H.. Gdyby proces zastępowania był kontynuowany, ostatecznie zostałby uzyskany: F.3do-H..
W tej ostatniej cząsteczce H. wykazuje, jako konsekwencja trzech sąsiadujących atomów F, wyraźny niedobór elektronów. To δ + nie pozostaje niezauważone przez żaden gatunek wystarczająco bogaty w elektrony, aby go usunąć H. a zatem F3CH staje się ujemnie naładowany:
fa3do-H. + : N- (gatunki negatywne) => F.3DO:- + H.N
Powyższe równanie chemiczne można również rozpatrywać w ten sposób: F3CH przekazuje proton (H.+, the H. po odłączeniu od cząsteczki) a: N; o, F.3CH otrzymuje parę elektronów z H. jako że druga para została przekazana temu drugiemu od: N-.
- Kwasowość lub stała
Ile F3DO:- czy jest obecny w roztworze? Albo ile cząsteczek F3CH może przekazać kwas wodorowy N? Aby odpowiedzieć na te pytania, konieczne jest określenie stężenia F3DO:- lub z H.N i używając równania matematycznego, ustal wartość liczbową zwaną stałą kwasowości Ka.
Im więcej cząsteczek F3DO:- lub HN, tym więcej kwasu będzie F3CH i większy to Ka. W ten sposób Ka pomaga wyjaśnić ilościowo, które związki są bardziej kwaśne niż inne; i podobnie, odrzuca jako kwasy te, których Ka jest bardzo małego rzędu.
Niektóre Ka mogą mieć wartości około 10-1 i 10-5, i inni, ceni milionowe części mniejsze, np. 10-piętnaście i 10-35. Można zatem powiedzieć, że te ostatnie, mając wymienione stałe kwasowości, są bardzo słabymi kwasami i jako takie można je wyrzucić..
Więc która z poniższych cząsteczek ma najwyższy Ka: CH4, CH3F, CHdwafadwa lub CHF3? Odpowiedź tkwi w braku gęstości elektronów δ + w ich wodorach..
Pomiary
Ale jakie są kryteria standaryzacji pomiarów Ka? Jego wartość może się ogromnie różnić w zależności od tego, który gatunek otrzyma H.+. Na przykład, jeśli: N jest mocną zasadą, Ka będzie duże; ale jeśli wręcz przeciwnie, jest to bardzo słaba podstawa, Ka będzie małe.
Pomiary Ka są wykonywane przy użyciu najpowszechniejszej i najsłabszej ze wszystkich zasad (i kwasów): wody. W zależności od stopnia darowizny H.+ do cząsteczek H.dwaLub w temperaturze 25 ° C i pod ciśnieniem jednej atmosfery ustala się standardowe warunki w celu określenia stałych kwasowości dla wszystkich związków.
Z tego wynika repertuar tablic stałych kwasowości dla wielu związków, zarówno nieorganicznych, jak i organicznych..
- Ma bardzo stabilne zasady koniugatu
Kwasy mają silnie elektroujemne atomy lub jednostki (pierścienie aromatyczne) w swoich strukturach chemicznych, które przyciągają gęstości elektronów z otaczających wodorów, powodując, że stają się one częściowo dodatnie i reaktywne z zasadą.
Po oddaniu protonów kwas zamienia się w sprzężoną zasadę; to znaczy gatunek negatywny zdolny do przyjmowania H.+ lub przekaż parę elektronów. Na przykładzie cząsteczki CF.3H jego koniugatem jest CF3-:
CF3- + HN <=> CHF3 + : N-
Tak CF3- jest bardzo stabilną podstawą sprzężoną, równowaga będzie przesunięta bardziej w lewo niż w prawo. Im bardziej jest stabilny, tym bardziej reaktywny i kwaśny będzie kwas..
Skąd wiesz, jak są stabilne? Wszystko zależy od tego, jak sobie poradzą z nowym ładunkiem ujemnym. Jeśli uda im się go zdelokalizować lub skutecznie rozproszyć rosnącą gęstość elektronów, nie będzie on dostępny do wykorzystania w wiązaniu z podstawą H..
- Mogą mieć ładunki dodatnie
Nie wszystkie kwasy mają wodory z niedoborem elektronów, ale mogą mieć również inne atomy zdolne do przyjmowania elektronów, z ładunkiem dodatnim lub bez..
Jak to jest? Na przykład w trifluorku boru BF3, atomowi B brakuje oktetu wartościowości, więc może on utworzyć wiązanie z dowolnym atomem, który daje mu parę elektronów. Jeśli anion F- w jego pobliżu zachodzi następująca reakcja chemiczna:
BF3 + fa- => BF4-
Z drugiej strony wolne kationy metali, takie jak Al3+, Zndwa+, Na+, itp. są uważane za kwaśne, ponieważ ze swojego środowiska mogą przyjmować wiązania celownicze (koordynacyjne) gatunków bogatych w elektrony. Reagują również z jonami OH- wytrącać się jako wodorotlenki metali:
Zndwa+(aq) + 2OH-(ac) => Zn (OH)dwa(s)
Wszystkie z nich są znane jako kwasy Lewisa, podczas gdy te, które przekazują protony, to kwasy Bronsteda..
- Ich roztwory mają wartości pH mniejsze niż 7
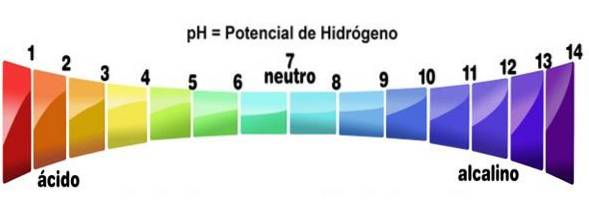
Dokładniej, gdy kwas rozpuszcza się w jakimkolwiek rozpuszczalniku (który nie neutralizuje go w znacznym stopniu), tworzy roztwory o pH niższym niż 3, chociaż poniżej 7 uważa się je za bardzo słabe kwasy..
Można to zweryfikować za pomocą wskaźnika kwasowo-zasadowego, takiego jak fenoloftaleina, wskaźnik uniwersalny lub sok z fioletowej kapusty. Te związki, które zmieniają kolor na wskazane dla niskiego pH, są traktowane jako kwasy. To jeden z najprostszych testów pozwalających określić ich obecność..
To samo można zrobić na przykład dla różnych próbek gleby z różnych części świata, określając w ten sposób ich wartości pH, aby wraz z innymi zmiennymi je scharakteryzować..
I wreszcie wszystkie kwasy mają kwaśny posmak, o ile nie są na tyle skoncentrowane, aby nieodwracalnie spalić tkanki języka..
- Zdolność do neutralizacji zasad
Arrhenius w swojej teorii proponuje, że kwasy, będąc zdolnymi do generowania protonów, reagują z hydroksylem zasad, tworząc sól i wodę w następujący sposób:
HCl + NaOH → NaCl + HdwaLUB.
Ta reakcja nazywa się neutralizacją i jest podstawą techniki analitycznej zwanej miareczkowaniem (Bruce Mahan, 1990).
Mocne kwasy i słabe kwasy
Kwasy dzieli się na mocne i słabe kwasy. Siła kwasu jest związana z jego stałą równowagi, stąd w przypadku kwasów te stałe nazywane są stałymi kwasowości Ka.
Zatem mocne kwasy mają dużą stałą kwasową, więc mają tendencję do całkowitej dysocjacji. Przykładami takich kwasów są kwas siarkowy, solny i azotowy, których stałe kwasowe są tak duże, że nie można ich zmierzyć w wodzie..
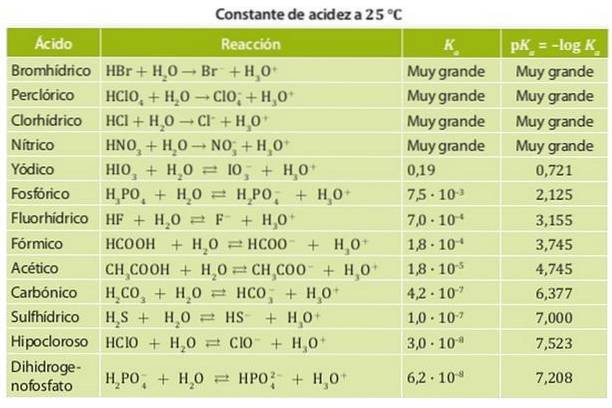
Z drugiej strony słaby kwas to taki, którego stała dysocjacji jest niska, więc znajduje się w równowadze chemicznej. Przykładami takich kwasów są kwas octowy i mlekowy oraz kwas azotawy, których stałe kwasowości są rzędu 10-4. Rysunek 1 przedstawia różne stałe kwasowości dla różnych kwasów.
Przykłady kwasów
Halogenki wodoru
Wszystkie halogenowodory są związkami kwaśnymi, zwłaszcza rozpuszczonymi w wodzie:
-HF (kwas fluorowodorowy).
-HCl (kwas solny).
-HBr (kwas bromowodorowy).
-HI (kwas jodowy).
Oksokwasy
Oksokwasy to protonowane formy oksoanionów:
HNO3 (kwas azotowy).
H.dwapołudniowy zachód4 (Kwas Siarkowy).
H.3PO4 (Kwas fosforowy).
HClO4 (kwas nadchlorowy).
Super kwasy
Super kwasy są mieszaniną mocnego kwasu Bronsteda i mocnego kwasu Lewisa. Po zmieszaniu tworzą złożone struktury, w których według niektórych badań H.+ „Wskocz” do ich wnętrza.
Ich korozyjna siła jest taka, że są miliardy razy silniejsze niż H.dwapołudniowy zachód4 stężony. Służą do rozbijania dużych cząsteczek obecnych w ropie naftowej na mniejsze, rozgałęzione cząsteczki i mają dużą wartość dodaną ekonomiczną..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3fa
-CF3południowy zachód3H.
Kwasy organiczne
Kwasy organiczne charakteryzują się jedną lub kilkoma grupami karboksylowymi (COOH), a wśród nich są:
-Kwas cytrynowy (obecny w wielu owocach)
-Kwas jabłkowy (z zielonych jabłek)
-Kwas octowy (z octu handlowego)
-Kwas masłowy (z zjełczałego masła)
-Kwas winowy (z win)
-I rodzina kwasów tłuszczowych.
Bibliografia
- Torrens H. Kwasy i zasady twarde i miękkie. [PDF]. Zaczerpnięte z: depa.fquim.unam.mx
- Helmenstine, dr Anne Marie (3 maja 2018). Nazwy 10 popularnych kwasów. Odzyskany z: thinkco.com
- Chempages Netorials. Kwasy i zasady: struktura molekularna i zachowanie. Zaczerpnięte z: chem.wisc.edu
- Deziel, Chris. (27 kwietnia 2018). Ogólna charakterystyka kwasów i zasad. Nauka. Odzyskany z: sciencing.com
- Pittsburgh Supercomputing Center (PSC). (25 października 2000). Odzyskany z: psc.edu.


Jeszcze bez komentarzy