
Struktura chlorynu sodu (NaClO2), właściwości, zastosowania, zagrożenia

Plik chlorek sodu jest nieorganicznym ciałem stałym utworzonym przez jon sodu Na+ i jon chlorynowy ClOdwa-. Jego wzór chemiczny to NaClOdwa. Jest to biała krystaliczna substancja stała, oprócz tego, że jest silnym środkiem utleniającym. Dlatego należy obchodzić się z nim bardzo ostrożnie..
Jego głównym zastosowaniem jest środek dezynfekujący do wielu zastosowań. Eliminuje drobnoustroje na powierzchniach, takich jak podłogi, ściany i sprzęt laboratoryjny w szpitalach i klinikach oraz w ich instalacjach wodnych.

Również w obiektach rolniczych i weterynaryjnych do odkażania inkubatorów do jaj drobiowych, do zwalczania zakażeń wymion krów mlecznych, do dezynfekcji systemów wodnych dla zwierząt itp..
W przemyśle spożywczym jego zakwaszone roztwory wodne służą do mycia mięs, kurczaków, owoców, warzyw, a także wyposażenia takich obiektów..
Dwutlenek chloru można przygotować z chlorynu sodu.dwa w miejscu użytkowania, co pozwala na wyeliminowanie drobnoustrojów, brzydkich zapachów i smaków z wody tak, aby była przyjemna i można ją było pić bez problemów.
Jest również stosowany między innymi do wybielania masy papierniczej, roślinnych włókien tekstylnych i olejów..
NaClOdwa Z ciałem stałym należy obchodzić się ostrożnie, ponieważ w kontakcie z niektórymi materiałami może dojść do wybuchu. Ich rozwiązania są nieco łatwiejsze w użyciu, ale są silnie utleniające i korodujące..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3.6 Inne właściwości
- 4 Ryzyka
- 5 Otrzymywanie
- 6 zastosowań
- 6.1 Jako środek bakteriobójczy i dezynfekujący w wielu zastosowaniach
- 6.2 Dezynfekcja wody pitnej
- 6.3 Do pielęgnacji soczewek kontaktowych
- 6.4 W różnych zastosowaniach
- 7 Referencje
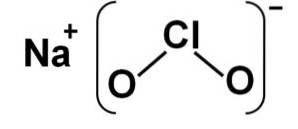
Struktura
Chloryn sodu składa się z kationu sodu Na+ i anion chlorynowy ClOdwa- dlatego są one połączone wiązaniem jonowym.
Anion chlorynowy ma jeden atom chloru na stopniu utlenienia +3 i dwa atomy tlenu o wartościowości -2 każdy. Z tego powodu anion chlorynowy ma ładunek ujemny..
Ma również strukturę w kształcie kąta.
Nomenklatura
- Chlorek sodu
- Chlorek sodu
- Sól sodowa kwasu chlorawego
Nieruchomości
Stan fizyczny
Stały, biały krystaliczny.
Waga molekularna
90,44 g / mol.
Temperatura topnienia
Rozkłada się, topiąc się w temperaturze od 180 do 200 ºC.
Gęstość
2,468 g / cm3
Rozpuszczalność
Rozpuszczalny w wodzie: 64 g / 100 g wody o temperaturze 17 ºC. Słabo rozpuszczalny w metanolu.
Inne właściwości
Jest lekko higroskopijny.
Jest silnym utleniaczem. Reaguje gwałtownie z materiałami palnymi i redukującymi. Reaguje gwałtownie z kwasami, wytwarzając dwutlenek chloru ClOdwa.
Jego roztwory zasadowe (czyli np. W obecności NaOH) są dość stabilne, podczas gdy w środowisku kwaśnym kwas chlorawym tworzy się HClOdwa, który szybko się psuje:
4 HClOdwa → 2 ClOdwa↑ + ClO3- + Cl- + 2 godz+ + H.dwaLUB
Ryzyka
Zarówno NaClOdwa Ciało stałe, ponieważ jego wodne roztwory są potencjalnie niebezpieczne i wymagają dużej ostrożności i doświadczenia podczas obsługi i przechowywania..
NaClOdwa ciało stałe może eksplodować w kontakcie z substancjami organicznymi, w tym rękawicami i odzieżą, materiałami zapobiegającymi wyciekom, takimi jak trociny i odpady bawełny, a także olejami i smarami.
Stała postać jest zatem bardzo trudna do transportu i korzystne jest stosowanie jej w postaci roztworów wodnych..
Te roztwory są wyjątkowo korozyjne. Najlepiej utrzymywać je przy pH powyżej 8, to znaczy o odczynie zasadowym.
NaClOdwa przyspiesza spalanie łatwopalnych związków lub materiałów do tego stopnia, że może tworzyć z nimi wybuchowe mieszaniny.
Po podgrzaniu wydziela toksyczne opary kwasu solnego HCl i tlenku sodu NadwaO. Długotrwała ekspozycja na ciepło lub ogień może wybuchnąć.
Otrzymywanie
Jest przygotowywany zaczynając od chemicznej lub elektrochemicznej redukcji chloranu sodu NaClO3, w obecności kwasu solnego HCl w celu wytworzenia dwutlenku chloru ClOdwa.
Ten ostatni reaguje z nadtlenkiem wodoru H.dwaLUBdwa w wodnym roztworze wodorotlenku sodu NaOH i roztworze chlorynu sodu NaClOdwa, który wyparowuje i ciało stałe krystalizuje.
Można go również uzyskać przepuszczając gazowy dwutlenek chloru ClOdwa roztworem NaOH.
2 ClOdwa + 2 NaOH → NaClOdwa + NaClO3 + H.dwaLUB
Aplikacje
Jako środek bakteriobójczy i dezynfekujący w wielu zastosowaniach
Jest składnikiem wielu produktów służących do zwalczania bakterii, grzybów i szlamu glonowego. Produkty, które go zawierają w tym celu, są używane w rolnictwie, handlu, przemyśle i rezydencjach lub domach..
Służy jako środek dezynfekujący do wielu rodzajów materiałów i powierzchni.
W rolnictwie, drobiarstwie i podobnych branżach dezynfekuje się twarde powierzchnie, sprzęt, urządzenia do inkubacji ptasich jaj, szklarnie dla grzybów, takich jak grzyby oraz systemy wody chłodzącej i wody w kurnikach..
Ma zastosowanie weterynaryjne jako miejscowy środek dezynfekujący w zwalczaniu zapalenia wymienia u bydła mlecznego, do zanurzania sutków zwierzęcia. Mastitis to infekcja wymion krów.

Jest również używany w przyrodniczych ośrodkach badawczych do odkażania laboratoriów.
Zastosowania komercyjne, przemysłowe i medyczne obejmują dezynfekcję systemów wentylacyjnych, twardych powierzchni (takich jak podłogi, ściany, sprzęt laboratoryjny) i systemów wodnych..
W placówkach służby zdrowia, takich jak przychodnie i szpitale, służy do odkażania pomieszczeń, korytarzy, izolatek oraz do sterylizacji materiałów..
Jest również przydatny do odkażania w placówkach, w których ludzie poddawani są zabiegom leczniczym wodą lub spa.
W przemyśle spożywczym jest używany jako fumigant do konserwowania żywności.
Stosowany jest w postaci zakwaszonego chlorynu sodu. Jest to wytwarzane przez dodanie kwasu spożywczego (na przykład kwasu cytrynowego, kwasu fosforowego, kwasu jabłkowego lub kwaśnego siarczanu sodu) do wodnego roztworu chlorynu sodu..
Zakwaszony chloryn sodu ma właściwości przeciwdrobnoustrojowe i jest stosowany jako roztwór w sprayu lub do mycia lub namaczania kurczaków, mięs, warzyw, owoców i owoców morza. Również w wodzie do zamrażania kurczaka lub drobiu.
W mieszkaniach umożliwia dezynfekcję twardych powierzchni, takich jak podłogi i łazienki, instalacje grzewcze lub klimatyzacyjne, systemy cyrkulacji wody basenowej..


Jest również sprzedawany w małych saszetkach wraz z innymi związkami uwalniającymi gaz i kontrolującymi zapachy w domach..
Do dezynfekcji wody pitnej
Służy do oczyszczania wody pitnej, działa utleniająco, poprawiając smak i zapach wody pitnej.
Chloryn sodu jest szeroko stosowany jako prekursor do wytwarzania dwutlenku chloru ClOdwa stosowany do uzdatniania wody pitnej do spożycia przez ludzi, czyli do eliminacji mikroorganizmów, zapachów i nieprzyjemnych smaków oraz można go pić.
Aby wygenerować ClOdwa HCl można stosować:
5 NaClOdwa + 4 HCl → 4 ClOdwa↑ + 5 NaCl + 2 H.dwaLUB
ClOdwa jest środkiem przeciwbakteryjnym o silnym działaniu utleniającym i szerokim spektrum. Oznacza to, że działa przeciwko dużej liczbie mikroorganizmów.
Mikroorganizmy są inaktywowane, ponieważ ClOdwa zakłóca działanie ważnych enzymów tych enzymów i białek błon komórkowych. Ma również tę zaletę, że nie wytwarza toksycznych związków chloroorganicznych..
W sprzedaży są tabletki chlorynu sodu zmieszane z innymi związkami, które rozpuszczają się w wodzie i natychmiast wytwarzają ClOdwa w kontrolowany sposób, dezynfekując wodę.

Głównym problemem związanym z uzdatnianiem wody w celu usunięcia smaków i zapachów za pomocą ClOdwa polega na tym, że podczas leczenia mogą powstawać toksyczne chloryny i chlorany.
Do pielęgnacji soczewek kontaktowych
NaClOdwa jest składnikiem roztworów służących do dezynfekcji soczewek kontaktowych.
Stosowana jest kombinacja NaClOdwa i ślady (bardzo małe ilości) nadtlenku wodoru H.dwaLUBdwa.
HdwaLUBdwa stabilizuje ClOdwa który się tworzy, a połączenie obu jest bardzo skuteczne przeciwko bakteriom, grzybom i drożdżom. Powstałe produkty to chlorek sodu NaCl, woda i tlen, które są nieszkodliwe, co oznacza, że nie są szkodliwe dla oczu.
Po wyjęciu soczewek z roztworu NaClOdwa Pozostałość szybko rozkłada się na NaCl i Odwa. Pozostałości nadtlenku nie podrażniają oczu. Dlatego te rozwiązania są bardzo bezpieczne.

W różnych zastosowaniach
Chloryn sodu służy do wytwarzania dwutlenku chloru ClOdwa do natychmiastowego użycia w wielu zastosowaniach, z których niektóre zostały omówione w poprzednich akapitach.
Służy do wybielania miazgi drzewnej, tekstyliów, takich jak bawełna, włókna roślinne, jadalne i niejadalne oleje, tłuszcze, pokosty, lakiery i woski.
Jest składnikiem kropli do oczu i niektórych płynów do płukania ust..
Znajduje zastosowanie w przemyśle skórzanym oraz w środkach do galwanizacji metali (powlekanie metali).
Bibliografia
- Williams, L. i in. (2019). Mikrobiologia, pielęgnacja i konserwacja soczewek. W soczewkach kontaktowych (wydanie szóste). Odzyskany z sciencedirect.com.
- NAS. National Library of Medicine. (2019). Chlorek sodu. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Gray, N.F. (2014). Dwutlenek chloru. Proces technologii. In Microbiology of Waterborne Diseases (wydanie drugie). Odzyskany z sciencedirect.com.
- McKeen, L. (2012). Wprowadzenie do napromieniania żywności i sterylizacji medycznej. Dwutlenek chloru. W efekcie sterylizacji tworzyw sztucznych i elastomerów (wydanie trzecie). Odzyskany z sciencedirect.com.
- Ortenberg, E. i Telsch, B. (2003). Problemy ze smakiem i zapachem w wodzie pitnej. W Handbook of Water and Wastewater Microbiology. Odzyskany z sciencedirect.com.
- Karsa, D.R. (2007). Biocydy. Dwutlenek chloru. W Podręczniku czyszczenia / odkażania powierzchni. Odzyskany z sciencedirect.com.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. VCH Verlagsgesellschaft mbH.



Jeszcze bez komentarzy