
Struktura, właściwości, zastosowanie chlorku chromu (CrCl3)
Plik chlorek chromu (CrCl3) to nieorganiczna sól złożona z kationów Cr3+ i aniony Cl- w stosunku 1: 3; to znaczy dla każdego Cr3+ istnieją trzy Cl-. Jak okaże się później, ich interakcje nie są jonowe. Sól ta może występować w dwóch postaciach: bezwodnej i heksahydratu..
Postać bezwodna charakteryzuje się czerwonawo-fioletowym zabarwieniem; podczas gdy heksahydrat, CrCl3.6HdwaLub jest ciemnozielony. Włączenie cząsteczek wody modyfikuje właściwości fizyczne wspomnianych kryształów; takie jak ich temperatura wrzenia i topnienia, gęstość itp..

Chlorek chromu (III) (zgodnie z nomenklaturą zapasów) rozkłada się w wysokich temperaturach, przekształcając się w chlorek chromu (II), CrCldwa. Działa korodująco na metale, chociaż jest stosowany w chromowaniu: procedurze, w której metale są powlekane cienką warstwą chromu.
Cr3+, Pochodzący z odpowiedniego chlorku jest stosowany w leczeniu cukrzycy, zwłaszcza u pacjentów z całkowitym odżywianiem pozajelitowym (TPN), którzy nie spożywają wymaganej ilości chromu. Jednak wyniki są znacznie lepsze (i bardziej wiarygodne), jeśli są dostarczane w postaci pikolinianu..
Indeks artykułów
- 1 Struktura chlorku chromu
- 1.1 Krystaliczne warstwy bezwodnego
- 2 Właściwości
- 2.1 Nazwy
- 2.2 Wzór chemiczny
- 2.3 Masa cząsteczkowa
- 2.4 Opis fizyczny
- 2.5 Temperatura topnienia
- 2.6 Temperatura wrzenia
- 2.7 Rozpuszczalność w wodzie
- 2.8 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.9 Gęstość
- 2.10 Temperatura przechowywania
- 2.11 Rozkład
- 2.12 Korozja
- 2.13 Reakcje
- 2,14 pH
- 3 Synteza
- 4 Zastosowania
- 4.1 Przemysłowe
- 4.2 Terapia
- 5 Ryzyka
- 6 Odnośniki
Struktura chlorku chromu
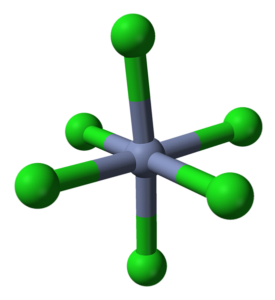
CrCl3 Pomimo tego, że jest solą, natura jej interakcji nie jest czysto jonowa; mają pewien charakter kowalencyjny, produkt koordynacji między Cr3+ i Cl-, które dają początek zdeformowanemu ośmiościanowi (górny obraz). Chrom znajduje się w środku ośmiościanu, a chlor w jego wierzchołkach.
Ośmiościan CrCl6 na pierwszy rzut oka może zaprzeczać formule CrCl3; jednak ten kompletny ośmiościan nie definiuje komórki elementarnej kryształu, ale raczej sześcian (również zdeformowany), który przecina zielone kule lub aniony chloru na pół.
Bezwodne warstwy krystaliczne
Zatem komórka elementarna z tym ośmiościanem nadal zachowuje stosunek 1: 3. Odtwarzając te zdeformowane kostki w przestrzeni, uzyskuje się kryształ CrCl3, który jest przedstawiony na górnym obrazku z trójwymiarowym modelem wypełnienia oraz modelem sfer i prętów.

Ta krystaliczna warstwa jest jedną z wielu, które tworzą łuszczące się czerwono-fioletowe kryształy CrCl.3 (nie myl koloru kryształu z kolorem zielonych kul).
Jak widać, aniony Cl- zajmują powierzchnię, więc ich ładunki ujemne odpychają inne krystaliczne warstwy. W konsekwencji kryształy stają się łuszczące i kruche; ale błyszczące, bo chromowane.
Jeśli te same warstwy są wizualizowane z perspektywy bocznej, zamiast ośmiościanów można zaobserwować zniekształcone czworościany:
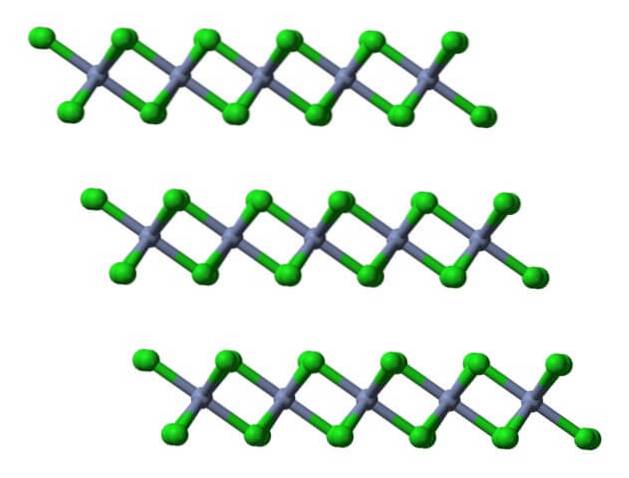
Tutaj jest dodatkowo ułatwione zrozumienie, dlaczego warstwy odpychają się, gdy wiążą się aniony Cl.- powierzchni.
Nieruchomości
Nazwy
-Chlorek chromu (III)
-Trichlorek chromu (III)
-Chlorek chromu (III) bezwodny.
Wzór chemiczny
-CrCl3 (bezwodny).
-CrCl3.6HdwaO (sześciowodzian).
Waga molekularna
-158,36 g / mol (bezwodna).
-266,43 g / mol (heksahydrat).
Opis fizyczny
-Czerwonawo-fioletowe ciała stałe i kryształy (bezwodne).
-Ciemnozielony krystaliczny proszek (heksahydrat, dolny obraz). W tym hydracie można zobaczyć, jak woda hamuje połysk, metaliczną cechę chromu.

Temperatura topnienia
-1152 ° C (2106 ° F, 1425 K) (bezwodny)
-83 ºC (sześciowodzian).
Temperatura wrzenia
1300ºC (2370ºF, 1570) (bezwodny).
Rozpuszczalność w wodzie
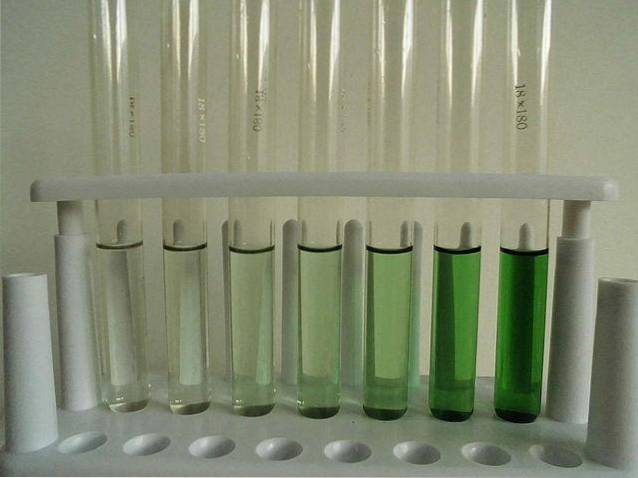
-Słabo rozpuszczalny (bezwodny).
-585 g / l (sześciowodzian).
Powyższy obrazek przedstawia serię probówek wypełnionych wodnym roztworem CrCl3. Zauważ, że im bardziej jest skoncentrowany, tym intensywniejszy jest kolor kompleksu [Cr (OHdwa)6]3+, odpowiedzialny za kolor zielony.
Rozpuszczalność w rozpuszczalnikach organicznych
Rozpuszczalny w etanolu, ale nierozpuszczalny w eterze (bezwodny).
Gęstość
-2,87 gr / cm3 (bezwodny).
-2,76 g / cm3 (sześciowodzian).
Temperatura przechowywania
Rozkład
Po podgrzaniu do rozkładu chlorek chromu (III) wydziela toksyczne opary związków zawierających chlor. Związki te są również uwalniane, gdy chlorek chromu (III) wchodzi w kontakt z mocnymi kwasami..
Korozja
Jest silnie korozyjny i może atakować niektóre stale.
Reakcje
Jest niekompatybilny z silnymi utleniaczami. Reaguje również silnie z litem i azotem..
Po ogrzaniu w obecności wodoru redukuje się do chlorku chromu (II), z utworzeniem chlorowodoru.
2 CrCl3 + H.dwa => 2 CrCldwa + 2 HCl
pH
W roztworze wodnym o stężeniu 0,2 M: 2,4.
Synteza
Sześciowodzian chlorku chromu (III) jest wytwarzany w reakcji wodorotlenku chromu z kwasem solnym i wodą.
Cr (OH)3 + 3 HCl + 3 H.dwaO => CrCl3.6HdwaLUB
Następnie w celu uzyskania bezwodnej soli ogrzewa się CrCl3.6HdwaLub w obecności chlorku tionylu, SOCldwa, kwas solny i ciepło:
[Cr (H.dwaLUB)6] Cl3 + 6SOCldwa + ∆ → CrCl3 + 12 HCl + 6SOdwa
Alternatywnie CrCl3 otrzymywany przez przepuszczenie gazowego chloru przez mieszaninę chromu i tlenku węgla.
CrdwaLUB3 + 3 C + Cldwa => 2 CrCl3 + 3 CO
I wreszcie, najczęściej stosowaną metodą, jest ogrzewanie jego tlenku środkiem halogenującym, takim jak czterochlorek węgla:
CrdwaLUB3 + 3CCl4 + ∆ → 2CrCl3 + 3COCldwa
Aplikacje
Przemysłowy
Chlorek chromu bierze udział w wytwarzaniu chlorku chromu (II) in situ; odczynnik zaangażowany w redukcję halogenków alkilu oraz w syntezie halogenków (E) -alkenylu.
-Wykorzystywany jest w technice chromowania. Polega ona na osadzaniu za pomocą galwanizacji cienkiej warstwy chromu na metalowych przedmiotach lub innym materiale z celem dekoracyjnym, zwiększając w ten sposób odporność na korozję, a także twardość powierzchni..
-Służy jako zaprawa do tekstyliów, służąc jako łącznik między materiałem barwiącym a tkaniną przeznaczoną do barwienia. Ponadto znajduje zastosowanie jako katalizator do produkcji olefin i środków hydroizolacyjnych..
Lecznictwo
Stosowanie suplementu chlorku chromu USP jest zalecane u pacjentów, którzy otrzymują wyłącznie roztwory dożylne, podawane w celu całkowitego żywienia pozajelitowego (TPN). Dlatego tylko wtedy, gdy ci pacjenci nie spełniają wszystkich swoich potrzeb żywieniowych.
Chrom (III) jest częścią czynnika tolerancji glukozy, aktywatora reakcji promujących insulinę. Uważa się, że chrom (III) aktywuje metabolizm glukozy, białek i lipidów, ułatwiając działanie insuliny u ludzi i zwierząt.
Chrom jest obecny w wielu produktach spożywczych. Jednak jego stężenie nie przekracza 2 na porcję, przy czym brokuły są pokarmem o największej zawartości (11 µg). Dodatkowo wchłanianie chromu przez jelita jest niskie i wynosi od 0,4 do 2,5% spożytej ilości..
Utrudnia to ustalenie diety dostarczającej chrom. W 1989 roku National Academy of Sciences zaleciła od 50 do 200 µg / dzień jako odpowiednie spożycie chromu..
Ryzyka
Wśród możliwych zagrożeń związanych ze spożywaniem tej soli jako suplementu chromu są:
-Silne bóle brzucha.
-Nieprawidłowe krwawienie, które może obejmować trudności w gojeniu się rany, zaczerwienienie siniaków lub ciemnienie stolca spowodowane krwawieniem wewnętrznym.
-Podrażnienia układu pokarmowego powodujące wrzody żołądka lub jelit.
-Zapalenie skóry
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Chlorek chromu (III). Odzyskane z: en.wikipedia.org
- Chlorek chromu (III) [PDF]. Odzyskany z: alpha.chem.umb.edu
- PubChem. (2019). Sześciowodzian chlorku chromu. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Narodowy Instytut Zdrowia. (21 września 2018). Chrom: Arkusz informacyjny dotyczący suplementów diety. Odzyskany z: ods.od.nih.gov
- Tomlinson Carole A. (2019). Skutki uboczne chlorku chromu. Leaf Group Ltd. Źródło: healthfully.com


Jeszcze bez komentarzy