
Właściwości, struktura, zastosowania, zagrożenia chlorku manganu

Plik chlorek manganu to sól nieorganiczna, której wzór chemiczny to MnCldwa. Składa się z jonów Mndwa+ i Cl- w stosunku 1: 2; dla każdego kationu Mndwa+ jest dwa razy więcej anionów Cl-.
Sól ta może tworzyć różne hydraty: MnCldwa2HdwaO, (dwuwodzian), MnCldwa4HdwaO (czterowodzian) i MnCldwa6HdwaO (heksahydrat) Najpowszechniejszą formą soli jest tetrahydrat.

Na właściwości fizyczne chlorku manganu, takie jak gęstość, temperatura topnienia i rozpuszczalność w wodzie, wpływa stopień jego uwodnienia. Na przykład temperatura topnienia postaci bezwodnej jest znacznie wyższa niż formy tetrahydratu..
Kolor chlorku manganu jest bladoróżowy (górne zdjęcie). Bladość jest charakterystyczna dla soli metali przejściowych. Chlorek manganu jest słabym kwasem Lewisa.
Minerał znany jako escacquita to naturalnie bezwodna postać chlorku manganu (II); jak kempita.
Chlorek manganu (II) jest stosowany jako stop; katalizator w reakcjach chlorowania itp..
Indeks artykułów
- 1 Właściwości fizyczne
- 1.1 Wygląd fizyczny
- 1.2 Masy molowe
- 1.3 Temperatury topnienia
- 1.4 Temperatura wrzenia
- 1.5 Gęstości
- 1.6 Rozpuszczalność w wodzie
- 1.7 Rozpuszczalność w rozpuszczalnikach organicznych
- 1.8 Rozkład
- 1,9 pH
- 1.10 Stabilność
- 2 Struktura chlorku manganu
- 2.1 Dwuwodzian
- 2.2 Bezwodny
- 3 Nazewnictwo
- 4 Zastosowania
- 4.1 Laboratorium
- 4.2 Przemysł
- 4.3 Nawozy i pasza dla zwierząt
- 5 Ryzyka
- 6 Odnośniki
Właściwości fizyczne
Wygląd fizyczny
- Postać bezwodna: różowe kryształki sześcienne.
- Postać czterowodzian: lekko rozpływające się czerwonawe kryształy jednoskośne.
Masy molowe
- Bezwodny: 125,838 g / mol.
- Dwuwodzian: 161,874 g / mol.
- Tetrahydrat: 197,91 g / mol.
Temperatury topnienia
- Bezwodny: 654 ºC.
- Dwuwodzian: 135 ºC.
- Czterowodzian: 58 ºC.
Temperatura wrzenia
Postać bezwodna: 1190 ºC.
Gęstości
- Bezwodny: 2977 g / cm3.
- Dwuwodzian: 2,27 g / cm3.
- Tetrahydrat: 2,01 g / cm3.
Rozpuszczalność w wodzie
Postać bezwodna: 63,4 g / 100 ml w 0 ° C; 73,9 g / 100 ml w 20 ° C; 88,5 g / 100 ml w 40 ° C; i 123,8 g / 100 ml w 100 ° C.
Rozpuszczalność w rozpuszczalnikach organicznych
Rozpuszczalny w pirydynie i etanolu, nierozpuszczalny w eterze.
Rozkład
O ile nie zostaną podjęte odpowiednie środki ostrożności, odwodnienie postaci uwodnionych do postaci bezwodnej może prowadzić do odwodnienia hydrolitycznego, z wytworzeniem chlorowodoru i tlenochlorku manganu..
pH
0,2 M roztwór tetrahydratu chlorku manganu w roztworze wodnym ma pH 5,5.
Stabilność
Jest stabilny, ale wrażliwy na wilgoć i niekompatybilny z silnymi kwasami, metalami reaktywnymi i nadtlenkiem wodoru.
Struktura chlorku manganu

Zaczynając od soli tetrahydratowanej, z efektownymi różowymi kryształami, musi składać się z kompleksów koordynacyjnych (górne zdjęcie). W nich metaliczne centrum Mndwa+ jest otoczony ośmiościanem zdefiniowanym przez cztery cząsteczki H.dwaO i dwa aniony Cl-.
Zauważ, że ligandy Cl- znajdują się na pozycjach cis; wszystkie są równoważne w prostokątnej podstawie ośmiościanu i nie ma znaczenia, czy Cl zostanie „przesunięty”- na dowolną z pozostałych trzech pozycji. Innym możliwym izomerem tej współrzędnej cząsteczki jest, w którym zarówno Cl- są w pozycjach trans; to znaczy w różnych skrajnościach (jedna powyżej i druga poniżej).
Cztery cząsteczki wody z ich wiązaniami wodorowymi pozwalają na połączenie dwóch lub więcej ośmiościanów siłami dipol-dipol. Te mosty są wysoce kierunkowe i dodają oddziaływania elektrostatyczne między Mndwa+ i Cl-, ustalić uporządkowaną strukturę charakterystyczną dla kryształu.
Różowy kolor MnCldwa4HdwaCzy jest to spowodowane elektronicznymi przejściami Mndwa+ i jego konfiguracja d5. Podobnie zakłócenia spowodowane bliskością cząsteczek wody i chlorków modyfikują ilość energii wymaganej do pochłonięcia przez takie elektrony d5 podróżować z wyższymi poziomami energii.
Dwuwodzianu
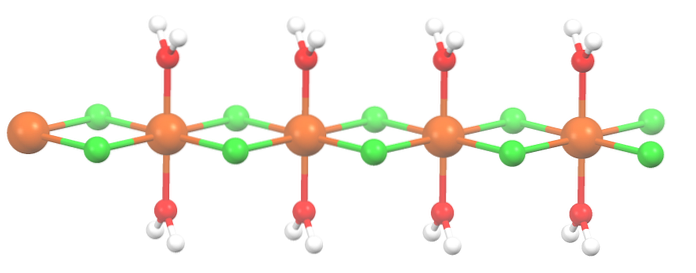
Sól została odwodniona, a jej formuła to MnCldwa2HdwaO. A co z ośmiościanem powyżej? Nic poza tym, że dwie cząsteczki H.dwaAlbo te, które wypadły, zostały zastąpione przez dwa Cl-.
Na początku możesz odnieść błędne wrażenie, że istnieją cztery Cl- dla każdego Mndwa+; jednak połowa ośmiościanu (osiowo) jest w rzeczywistości powtarzającą się jednostką kryształu.
Zatem prawdą jest, że istnieje Mndwa+ skoordynowane z dwoma Cl- i dwie cząsteczki wody w pozycjach trans. Ale aby ta jednostka mogła współdziałać z inną, potrzebuje dwóch mostów Cl, co z kolei umożliwia ukończenie ośmiościanu koordynacyjnego dla manganu..
Oprócz mostków Cl, cząsteczki wody również współpracują ze swoimi wiązaniami wodorowymi, tworząc łańcuch MnCldwa2HdwaAlbo nie rozbrajaj.
Bezwodny
Wreszcie chlorek magnezu przestał tracić całą wodę zawartą w jego kryształach; mamy teraz bezwodną sól MnCldwa. Bez cząsteczek wody kryształy zauważalnie tracą intensywność swojego różowego zabarwienia. Ośmiościan, podobnie jak hydraty, pozostaje niezmieniony z powodu samej natury manganu.
Bez cząsteczek wody, Mndwa+ końce otoczone ośmiościanem złożonym tylko z Cl-. To wiązanie koordynacyjne ma charakter zarówno kowalencyjny, jak i jonowy; z tego powodu zwykle odnosi się do struktury MnCldwa jak polimerowy kryształ. W nim są naprzemienne warstwy Mn i Cl.
Nomenklatura
Mangan ma wiele możliwych stopni utlenienia. Z tego powodu tradycyjna nomenklatura dla MnCldwa nie jest to wyjaśnione.
Z drugiej strony chlorek manganu odpowiada swojej lepiej znanej nazwie, do której należałoby dodać „(II)”, aby był zgodny z nomenklaturą surowców: chlorek manganu (II). I podobnie istnieje systematyczna nomenklatura: dichlorek manganu.
Aplikacje
Laboratorium
Chlorek manganu służy jako katalizator chlorowania związków organicznych.
Przemysł
Chlorek manganu jest stosowany jako surowiec do produkcji przeciwstuków do benzyny; materiał spawalniczy do metali nieżelaznych; pośrednik w produkcji pigmentów; i suszarnia oleju lnianego.
Znajduje zastosowanie w przemyśle tekstylnym do drukowania i barwienia; przy produkcji różnych soli manganu, w tym trikarbonylu metylocyklopentadienylomanganu stosowanego jako barwnik do cegieł; oraz w produkcji suchych ogniw elektrycznych.
Chlorek manganu jest stosowany jako stop i jest dodawany do stopionego magnezu w celu wytworzenia stopów manganu i magnezu; jako półprodukt do przygotowania środków suszących do farb i lakierów; oraz jako składnik środków dezynfekujących.
Jest również używany do oczyszczania magnezu.
Nawozy i pasza dla zwierząt
Chlorek manganu jest źródłem manganu, pierwiastka, który choć nie jest podstawowym składnikiem pokarmowym roślin, takim jak azot, fosfor i potas, jest wykorzystywany w licznych reakcjach biochemicznych typowych dla tych żywych istot..
Podobnie jest dodawany do karmy zwierząt hodowlanych w celu dostarczania manganu, niezbędnego pierwiastka śladowego dla wzrostu zwierząt..
Chlorek manganu jest składnikiem diety dostarczającym mangan, pierwiastek biorący udział w wielu procesach niezbędnych do życia, m.in .: syntezie kwasów tłuszczowych i hormonów płciowych; przyswajanie witaminy E; produkcja chrząstki; itp.
Ryzyka
W kontakcie ze skórą może powodować zaczerwienienie, podrażnienie i zapalenie skóry. Chlorek manganu powoduje zaczerwienienie, podrażnienie i łzawienie oczu.
Wdychana sól wywołuje kaszel, ból gardła i duszność. Z drugiej strony połknięcie może spowodować wymioty, nudności i biegunkę..
Przewlekłe nadmierne wdychanie tej soli może prowadzić do zapalenia płuc i późniejszej reaktywnej choroby dróg oddechowych..
Jego nadmierne spożycie może powodować zaburzenia psychiczne, odwodnienie, niedociśnienie, niewydolność wątroby i nerek, niewydolność układu wielonarządowego i śmierć..
Neurotoksyczność jest początkowym objawem niepożądanego działania manganu i może objawiać się bólami głowy, zawrotami głowy, utratą pamięci, hiperrefleksją i łagodnym drżeniem..
Ciężka toksyczność objawia się objawami i oznakami podobnymi do tych obserwowanych w chorobie Parkinsona.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Chlorek manganu (II). Odzyskane z: en.wikipedia.org
- Nanomateriały Sky Spring. (2016). Proszek chlorku manganu. Odzyskany z: ssnano.com
- Książka chemiczna. (2017). Chlorek manganu. Odzyskane z: chemicalbook.com
- Sieć danych toksykologicznych. (s.f.). Chlorek manganu. Toxnet. Odzyskany z: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Chlorek manganu (II). doi.org/10.1002/047084289X.rm020
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Dichlorek manganu. Baza danych PubChem. CID = 24480. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Minerały: mangan. Odzyskany z: webconsultas.com


Jeszcze bez komentarzy