
Właściwości, struktura, zastosowania, chlorku ołowiu
Plik chlorek ołowiu to sól nieorganiczna, której wzór chemiczny to PbCln, gdzie n jest stopniem utlenienia ołowiu. Więc kiedy ołów wynosi +2 lub +4, sól to PbCldwa lub PbCl4, odpowiednio. Dlatego istnieją dwa rodzaje chlorków dla tego metalu.
Z tych dwóch PbCldwa jest najważniejszy i stabilny; podczas gdy PbCl4 jest niestabilny i mniej przydatny. Pierwsza ma charakter jonowy, gdzie kation Pbdwa+ generuje oddziaływania elektrostatyczne z anionem Cl- zbudować sieć krystaliczną; a drugi jest kowalencyjny, z wiązaniami Pb-Cl dającymi początek czworościanowi ołowiu i chloru.

Inną różnicą między dwoma chlorkami ołowiu jest PbCldwa Jest to bryła białych kryształów w kształcie igieł (górne zdjęcie); podczas gdy PbCl4 Jest to żółtawy olej, który może krystalizować w temperaturze -15ºC. Wejście PbCldwa jest bardziej estetyczny niż PbCl4.
Oprócz tego, co już zostało wspomniane, PbCldwa występuje w naturze jako składnik mineralny; podczas gdy PbCl4 nie, ponieważ jest podatny na próchnicę. Chociaż z PbCl4 możesz dostać PbOdwa, PbCldwa uzyskać nieskończoną różnorodność związków metaloorganicznych.
Indeks artykułów
- 1 Właściwości
- 1,1 -chlorek ołowiu (II)
- 1.2 Chlorek ołowiu (IV)
- 2 Struktura
- 2.1 - Chlorek ołowiu (II)
- 2.2 Cząsteczka w fazie gazowej
- 3 Nazewnictwo
- 4 Zastosowania
- 5 Referencje
Nieruchomości
Właściwości chlorku ołowiu są zasadniczo zależne od stopnia utlenienia ołowiu; ponieważ chlor się nie zmienia, ale sposób, w jaki oddziałuje z ołowiem, zmienia się. Dlatego oba związki należy rozpatrywać oddzielnie; chlorek ołowiu (II) z jednej strony i chlorek ołowiu (IV) z drugiej.
-Chlorek ołowiu (II)
Masa cząsteczkowa
278,10 g / mol.
Wygląd fizyczny
Białe kryształy z kształtami igieł.
Gęstość
5,85 g / ml.
Temperatura topnienia
501ºC.
Temperatura wrzenia
950ºC.
Rozpuszczalność w wodzie
10,8 g / l przy 20 ° C. Jest słabo rozpuszczalny i wodę należy podgrzać, aby znaczna ilość mogła się rozpuścić.
Współczynnik załamania światła
2,199.
Chlorek ołowiu (IV)
Masa cząsteczkowa
349,012 g / mol.
Wygląd fizyczny
Żółtawa, oleista ciecz.
Gęstość
3,2 g / ml.
Temperatura topnienia
-15ºC.
Temperatura wrzenia
50 ° C W wyższych temperaturach rozkłada się uwalniając gazowy chlor:
PbCl4(s) => PbCldwa(s) + Cldwa(sol)
W rzeczywistości ta reakcja może stać się bardzo wybuchowa, więc PbCl jest przechowywany.4 w kwasie siarkowym w temperaturze -80ºC.
Struktura
-Chlorek ołowiu (II)
Na początku wspomniano, że PbCldwa jest związkiem jonowym, więc składa się z jonów Pbdwa+ i Cl- które tworzą kryształ, w którym ustala się stosunek Pb: Cl równy 1: 2; to znaczy, jest dwa razy więcej anionów Cl- jakie kationy Pbdwa+.
W rezultacie powstają kryształy rombowe, których jony można przedstawić za pomocą modelu sfer i prętów, jak na poniższym obrazku..

Ta struktura również odpowiada strukturze minerału kotunitu. Chociaż słupki służą do wskazania kierunkowości wiązania jonowego, nie należy go mylić z wiązaniem kowalencyjnym (lub przynajmniej czysto kowalencyjnym).
W tych rombowych kryształach Pbdwa+ (szare kule) ma dziewięć Cl- (zielone kule) otaczające go, jakby był zamknięty w trójkątnym pryzmacie. Ze względu na zawiłość struktury i niską gęstość jonową Pbdwa+, cząsteczkom trudno jest solwatować kryształ; powód, dla którego jest słabo rozpuszczalny w zimnej wodzie.
Cząsteczka fazy gazowej
Kiedy ani kryształ, ani ciecz nie są w stanie wytrzymać wysokich temperatur, jony zaczynają parować jako cząsteczki PbCl.dwa dyskretny; to znaczy z wiązaniami kowalencyjnymi Cl-Pb-Cl i kątem 98º, jakby to był bumerang. Następnie mówi się, że faza gazowa składa się z tych cząsteczek PbCldwa i nie ma jonów przenoszonych przez prądy powietrza.
Chlorek ołowiu (IV)
Tymczasem PbCl4 jest to związek kowalencyjny. Dlaczego? Ponieważ kation Pb4+ jest mniejszy i ma również wyższą gęstość ładunku jonowego niż Pbdwa+, co powoduje większą polaryzację chmury elektronów Cl-. W rezultacie zamiast interakcji typu jonowego Pb4+Cl-, powstaje wiązanie kowalencyjne Pb-Cl.
Biorąc to pod uwagę, podobieństwo między PbCl4 i, na przykład, CCl4; obie występują jako pojedyncze cząsteczki tetraedryczne. W ten sposób wyjaśniono, dlaczego ten chlorek ołowiu jest żółtawym olejem w normalnych warunkach; Atomy Cl są słabo ze sobą spokrewnione i „ślizgają się”, gdy dwie cząsteczki PbCl4 oni nadchodzą.
Jednak gdy temperatura spada, a cząsteczki zwalniają, prawdopodobieństwo i skutki chwilowych dipoli (PbCl4 jest niepolarny ze względu na swoją symetrię); a następnie olej zamarza w postaci żółtych sześciokątnych kryształów:
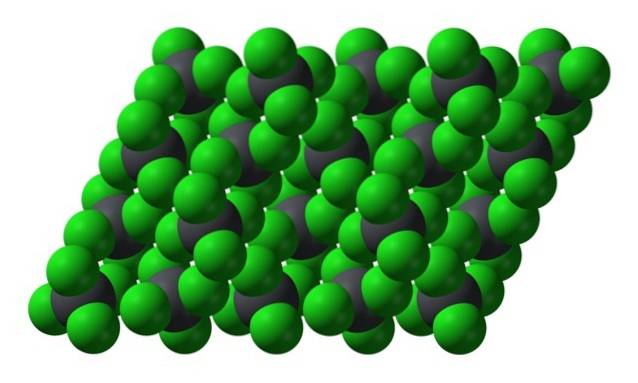
Zwróć uwagę, że każda szarawa kula jest otoczona czterema zielonymi kulami. Te cząsteczki PbCl4 „Ściśnięte razem” tworzą niestabilny kryształ, który jest podatny na energiczny rozkład.
Nomenklatura
Nazwy: chlorek ołowiu (II) i chlorek ołowiu (IV) odpowiadają nazwom przypisanym zgodnie z nomenklaturą Stock. Ponieważ stopień utlenienia +2 jest najniższy dla ołowiu, a +4 najwyższy, oba chlorki można nazwać zgodnie z tradycyjną nomenklaturą jako chlorek ołowiu (PbCldwa) i chlorek ołowiu (PbCl4), odpowiednio.
I wreszcie, istnieje systematyczna nomenklatura, która podkreśla liczbę każdego atomu w związku. Tak więc PbCldwa to dichlorek ołowiu i PbCl4 czterochlorek ołowiu.
Aplikacje
Nie jest znane praktyczne zastosowanie PbCl4 dodatkowo służy do syntezy PbOdwa. Jednak plik PbCldwa Jest bardziej przydatny i dlatego tylko niektóre zastosowania tego konkretnego chlorku ołowiu zostaną wymienione poniżej:
- Ze względu na swój wysoce luminescencyjny charakter przeznaczony jest do detektorów fotograficznych, akustycznych, optycznych i radiacyjnych.
- Ponieważ nie pochłania w zakresie widma podczerwieni, służy do produkcji okularów przepuszczających tego typu promieniowanie.
- Stanowiło część tak zwanego złotego szkła, atrakcyjnego materiału o opalizujących niebieskawych barwach, używanego do celów dekoracyjnych..
- Kontynuując temat sztuki, po alkalizacji PbCldwaPb (OH)dwa Nabiera intensywnych białawych tonów, będąc używany jako biały pigment ołowiowy. Jednak odradza się jego stosowanie ze względu na wysoką toksyczność..
- Roztopiony i zmieszany z tytanianem baru BaTiO3, pochodzi z ceramicznego tytanianu ołowiu i baru Ba1 - xPbxWujek3. Jeśli Pbdwa+ wejdź do BaTiO3, a Badwa+ musi opuścić kryształ, aby umożliwić jego włączenie, i wtedy mówi się, że zachodzi wymiana kationowa; stąd skład Badwa+ jest wyrażona jako 1-x.
- I wreszcie z PbCldwa syntetyzuje się kilka metaloorganicznych związków ołowiu o wzorze ogólnym R.4Pb lub R3Pb-PbR3.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Chlorek ołowiu (II). Odzyskane z: en.wikipedia.org
- Formulacja chemiczna. (2019). Chlorek ołowiu (IV). Odzyskany z: formulacionquimica.com
- Clark Jim. (2015). Chlorki węgla, krzemu i ołowiu. Źródło: chemguide.co.uk
- Spektralne i optyczne nieliniowe badania chlorku ołowiu (PbCldwa) kryształy. [PDF]. Odzyskany z: shodhganga.inflibnet.ac.in
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Chlorek ołowiu. Baza danych PubChem; CID = 24459. Odzyskany z: pubchem.ncbi.nlm.nih.gov



Jeszcze bez komentarzy