
Charakterystyka Corynebacterium pseudotuberculosis, morfologia
Corynebacterium pseudotuberculosis jest to bakteria z rzędu Actinomycetales. Jest to pałeczka, która w kulturach ma kształt młotka lub maczugi, nie ma torebki ani wici. Fermentacja maltozy i galaktozy, ale nie laktozy.
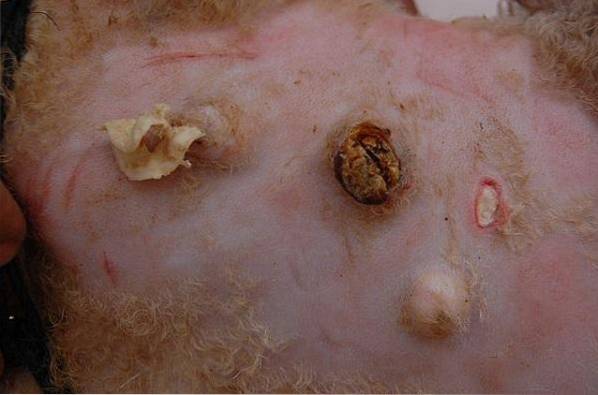
C. pseudotuberculosis jest fakultatywną bakterią wewnątrzkomórkową, która namnaża się w makrofagach swojego żywiciela. Może powodować wiele chorób, w tym sercowate zapalenie węzłów chłonnych (CLA) i wrzodziejące zapalenie naczyń chłonnych u zwierząt, takich jak kozy, jelenie, konie, bydło lub wielbłądy. Może również wpływać na ludzi.
Indeks artykułów
- 1 Charakterystyka ogólna
- 2 Morfologia
- 3 Taksonomia
- 4 Uprawa
- 5 Patogeneza
- 5.1 Wpływ egzotoksyn
- 6 Potencjał zoonotyczny Corynebacterium pseudotuberculosis
- 7 Referencje
Ogólna charakterystyka
Bakterie Corynebacterium pseudotuberculosis jest patogenem wewnątrzkomórkowym, Gram dodatnim, fakultatywnie beztlenowym, nie tworzy zarodników. Osiąga swój optymalny rozwój w temperaturze 37 ºC w pożywkach o neutralnym pH (między 7,0 a 7,2).
Wytwarza katalazę, fosfolipazę D i ureazę. Fermentuje maltozę, mannozę, glukozę i galaktozę. Nie fermentuje laktozy. Jest oksydazo-ujemny.
Nie wykazuje działania proteolitycznego ani nie hydrolizuje żelatyny. Nie trawi również kazeiny. Ma pyogenną warstwę lipidową, ale nie immunogenną. Warstwa ta utrudnia bakteriom fagocytozę, zwiększając w ten sposób ich zjadliwość i zdolność do przeżycia w makrofagach..
Morfologia
Organizmy tego gatunku są pleomorficzne (to znaczy występują w różnych odmiennych formach). Mogą mieć kształt kokosa lub nitkowatego pręta.
Zwykle są wydłużone, a ich wymiary mieszczą się w zakresie od 0,5 do 0,6 µm szerokości i 1,0 do 3,0 µm długości. Nie mają kapsułek ani wici, ale mają fimbrie i generalnie zawierają granulki metachromatyczne.
Jego ściana komórkowa zawiera kwasy mezo-diaminopimelinowy, arabinogalaktanowy i chorinomikolowy. Mają także arabinozy i galaktozę (cukry) oraz krótkie łańcuchy kwasu mykolowego.
Taksonomia
Gatunki C. gruźlica rzekoma Po raz pierwszy został opisany w 1888 roku przez Edmounda Nocarda, francuskiego lekarza weterynarii. Opis oparto na materiale wyizolowanym od bydła z zapaleniem naczyń chłonnych.
W 1891 r. Węgierski bakteriolog Hugo von Preisz wyizolował podobną bakterię atakującą owce. W związku z obydwoma ustaleniami bakteria została ochrzczona nazwą Bacillus "Preisz-Nocard"..
Płeć Corynebacterium Jest taksonomicznie zlokalizowany w podrzędu Corynebacterineae (Actinobacteria: Actinobacteridae: Actinomycetales). Podrząd ten obejmuje rodziny Corynebacteriaceae, Mycobacteriaceae i Nocardiaceae, które są powszechnie określane jako grupa CMN..
Bakterie z grupy CMN mają ścianę komórkową złożoną głównie z peptydoglikanów, arabinogalaktanu i kwasów mykolowych. Inną cechą charakterystyczną członków tej grupy jest to, że zawierają one udział guaniny i cytozyny, który może przekraczać 70% sumy zasad azotowych..
Grupa CMN obejmuje wiele gatunków o znaczeniu medycznym i weterynaryjnym, w tym C. gruźlica rzekoma, odpowiedzialny za pseudotuberculosis lub sercowate zapalenie węzłów chłonnych (CLA) u kóz i owiec oraz zakażenia szpitalne u ludzi.
Kultura
Corynebacterium pseudotuberculosis dobrze rośnie na pożywkach wzbogaconych, takich jak agar z krwią, pożywka Brain Heart Infusion (BHI) oraz pożywki wzbogacone surowicą zwierzęcą.
Hodowle na pożywkach BHI wzbogaconych ekstraktem z drożdży, tryptozą lub laktoalbuminą poprawiają wzrost bakterii. Do wzbogacenia pożywek hodowlanych zastosowano również polisorbat 80.
W pożywce stałej wzrost początkowy jest słaby, następnie wzrasta, a bakterie organizują się w grupy. Kolonie są suche, nieprzezroczyste i koncentryczne.
Wzrost w pożywkach płynnych zachodzi jako biofilm na powierzchni pożywki. Ten biofilm jest spowodowany obecnością i ilością lipidów w błonie komórkowej.
W obecności CO2 w atmosferze przy stężeniu 5% następuje lepszy rozwój bakterii. Ostatnio prowadzono hodowle w pożywkach składających się z dwuzasadowego fosforanu, witamin i aminokwasów..
Patogeneza
Corynebacterium pseudotuberculosis jest zdolny do wytwarzania różnych czynników wirulencji, jednakże kwasy chorinomikolowe i toksyna fosfolipazy D są głównie odpowiedzialne za jej potencjał do wywoływania chorób.
Te dwa czynniki wpływają na proces zapalny, pojawienie się obrzęku i rozprzestrzenianie się podczas rozwoju ropni..
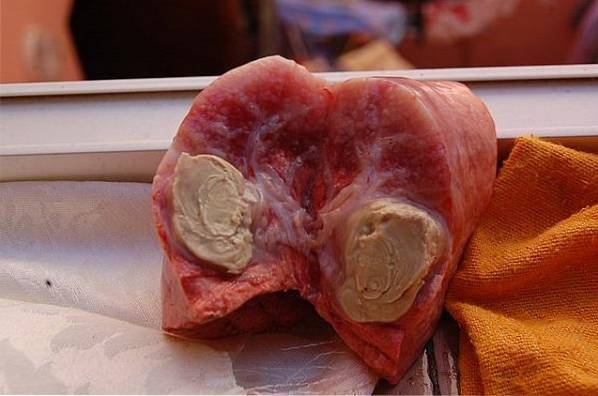
Bacillus rozmnaża się w makrofagach gospodarza. Zewnętrzna warstwa lipidowa ściany komórkowej pozwala jej przetrwać działanie enzymów fagolizosomalnych.
Bakterie na ogół dostają się do żywiciela przez błonę śluzową jamy ustnej, nosa lub oczu lub przez rany na skórze. Wewnątrz żywiciela Bacillus rozprzestrzenia się swobodnie lub w makrofagach.
Główną drogą rozprzestrzeniania się jest aferentny układ limfatyczny. Stamtąd rozprzestrzenia się do lokalnych węzłów chłonnych i narządów wewnętrznych..
Zakaźny proces bakterii zależy od jej zdolności do zakażania makrofagów gospodarza, odporności na jej fagolizosomy oraz zabijania komórek i uwalniania nowych bakterii. Eksperymentalne infekcje u myszy wykazały, że wakuole fagocytarne pojawiają się trzy minuty po inokulacji dootrzewnowej u myszy..
W przypadku zakażeń eksperymentalnych u kóz 60-80% ich makrofagów zawiera bakterie w godzinę po zaszczepieniu. Dwie godziny później kwaśna fosfataza jest obecna w pęcherzykach zawierających bakterie.
U owiec mikro ropnie rozwijają się w drenażu węzłów chłonnych jeden dzień po eksperymentalnym zakażeniu skóry. Trzy do 10 dni po zakażeniu tworzą się pyogranuloma.
Wpływ egzotoksyn
Egzotoksyny bakterii hydrolizują lecytynę i sfingomielinę obecne w błonach komórek śródbłonka krwi i naczyń limfatycznych gospodarza..
Ta hydroliza powoduje pęknięcie błony komórkowej, zwiększa przepuszczalność naczyń, pojawienie się obrzęku i ułatwia kolonizację żywiciela..
Jedna z tych egzotoksyn, fosfolipaza D, również hamuje reakcję neutrofili na bodźce chemiczne. Fosfolipaza D hamuje również zdolność komórek fagocytarnych do uwalniania cząsteczek cytotoksycznych o działaniu przeciwdrobnoustrojowym. Sprzyja to przetrwaniu i namnażaniu się bakterii u żywiciela..
Potencjał odzwierzęcy Corynebacterium pseudotuberculosis
Corynebacterium pseudotuberculosis powoduje choroby głównie u owiec i kóz. Jednak może powodować infekcje u szerokiego spektrum żywicieli, w tym ludzi. Z tego powodu, C. gruźlica rzekoma jest uważany za pojawiający się problem zdrowia publicznego.
Bakteria ta może wytwarzać toksynę błonicy, może również infekować ludzi i powodować ropne powiększenie węzłów chłonnych. Infekcje są tradycyjnie spowodowane kontaktem z zakażonymi zwierzętami hodowlanymi i produktami mlecznymi.
Istnieją jednak udokumentowane przypadki osób, które nabyły choroby wywołane przez C. gruźlica rzekoma w którym nie było wcześniej kontaktu ze skażonymi zwierzętami lub żywnością.
Bibliografia
- A.F.C. Nassar, G.T. Daniel, R. Ruiz, S. Miyashiro, E.M. Scannapieco, J.S. Neto, L. Gregory (2015). Porównanie diagnostyczne Corynebacterium pseudotuberculosis poprzez hodowlę mikrobiologiczną i PCR w próbkach owiec. Archiwa Instytutu Biologicznego w São Paulo.
- OGŁOSZENIE. Hawari (2008). Corynebacterium pseudotuberculosis zakażenie (sercowate zapalenie węzłów chłonnych) u wielbłądów (Camelus dromedarius) w Jordanii. American Journal of Animal and Veterinary Sciences.
- L.G.C. Pacheco, R.R. Pena, T.L.P. Castro, F.A. Dorella, R.C. Bahia, R. Carminati, M.N.L. Frota, S.C. Oliveira, R. Meyer, F.S.F. Alves, A. Miyoshi, V. Azevedo (2007). Test multipleksowy PCR do identyfikacji Corynebacterium pseudotuberculosis z czystych kultur i do szybkiego wykrywania tego patogenu w próbkach klinicznych. Journal of Medical Microbiology.
- FA. Dorella, L.G.C. Pacheco, S.C. Oliveira, A. Miyoshi, V. Azevedo (2006). Corynebacterium pseudotuberculosis: mikrobiologia, właściwości biochemiczne, patogeneza i molekularne badania wirulencji. Badania weterynaryjne.
- A. Ribeiro, F.A. Dorella, L.G.C. Pacheco, N. Seyffert, T.L.P. Castro, R.W.D. Portela, R. Meyer, A. Miyoshi, M.C.R. Luvizotto, V. Azevedo (2013). Diagnostyka subkliniczna serowatego zapalenia węzłów chłonnych na podstawie testu ELISA u owiec z Brazylii. Journal of Bacteriology and Parasitology.
- AS. Guimarães, F.B. Carmo, R.B. Pauletti, N. Seyffert, D. Ribeiro, A.P. Lage, M.B. Heinemann, A. Miyoshi, V. Azevedo, A.M. Guimarães Gouveia (2011) Caseous lymphadenitis: epidemiology, diagnostyka i kontrola. Dziennik IIOAB.

Jeszcze bez komentarzy