
Jakie są prawa ciężaru chemii? (Przykłady)
Plik prawa ciężkości chemii To ci, którzy pokazali, że masy reagujących substancji nie działają tak arbitralnie ani przypadkowo; ale zachowując stałą matematyczną proporcję liczb całkowitych lub ich podwielokrotności, w których atomy pierwiastków nie są ani tworzone, ani niszczone.
W przeszłości ustanowienie tych praw wymagało niezwykłych wysiłków rozumowania; ponieważ chociaż wydaje się to zbyt oczywiste teraz, zanim masy atomowe lub molekularne pierwiastków lub związków, odpowiednio, nie były nawet znane.

Ponieważ nie było wiadomo, ile dokładnie odpowiada jeden mol atomów każdego pierwiastka, chemicy w XVIII i XIX wieku musieli polegać na masach reagujących. Tak więc podstawowe wagi analityczne (górne zdjęcie) były nieodłącznymi towarzyszami podczas setek eksperymentów wymaganych do ustalenia praw wagi..
Z tego powodu studiując te prawa chemii, w każdym momencie natrafiasz na pomiary masy. Dzięki temu ekstrapolując wyniki eksperymentów odkryto, że związki chemiczne cygara są zawsze tworzone z takim samym udziałem masowym ich elementów składowych.
Indeks artykułów
- 1 Prawo zachowania masy
- 1.1-Eksperymenty Lavoisiera
- 1.2 - Równowaga równań
- 1.3 -Obliczenia
- 2 Prawo określonych proporcji
- 2.1 -Ilustracja prawa
- 2.2 -Aplikacje
- 2.3 -Obliczenia
- 3 Prawo proporcji wielokrotnych lub prawo Daltona
- 3.1 -Obliczenia
- 4 Prawo wzajemnych proporcji
- 4.1 - Przykłady
- 5 Referencje
Prawo zachowania masy
To prawo mówi, że w reakcji chemicznej całkowita masa reagentów jest równa całkowitej masie produktów; tak długo, jak rozpatrywany system jest zamknięty i nie ma wymiany masy i energii z otoczeniem.
W reakcji chemicznej substancje nie znikają, ale są przekształcane w inne substancje o tej samej masie; stąd słynne zdanie: „nic nie jest tworzone, nic nie jest niszczone, wszystko jest przekształcane”.
Historycznie rzecz biorąc, prawo zachowania masy w reakcji chemicznej zostało po raz pierwszy zaproponowane w 1756 roku przez Michaiła Łomonsowa, który przedstawił wyniki swoich eksperymentów w swoim dzienniku..
Później, w 1774 roku, Antoine Levoisier, francuski chemik, przedstawił wyniki swoich eksperymentów, które pozwoliły to ustalić; które, niektórzy nazywają to również prawem Lavoisiera.
-Eksperymenty Lavoisiera
W czasach Lavoisiera (1743-1794) istniała teoria Flogistonu, zgodnie z którą ciała miały zdolność zapalania się lub palenia. Eksperymenty Lavoisiera umożliwiły odrzucenie tej teorii.
Lavoisier przeprowadził liczne eksperymenty ze spalaniem metali. Ostrożnie zważył materiały przed i po spaleniu w zamkniętym pojemniku, stwierdzając, że nastąpił widoczny przyrost masy..
Jednak Lavoiser, opierając się na swojej wiedzy na temat roli tlenu w spalaniu, doszedł do wniosku, że przyrost masy podczas spalania wynikał z włączenia tlenu do spalanego materiału. Narodziła się koncepcja tlenków metali.
Dlatego suma mas metali poddanych spalaniu i tlenu pozostała niezmieniona. Wniosek ten pozwolił na ustanowienie Prawa Zachowania Mszy.
-Równoważenie równań
Prawo zachowania mas ustanowiło potrzebę zbilansowania równań chemicznych, gwarantując, że liczba wszystkich pierwiastków biorących udział w reakcji chemicznej, zarówno jako reagenty, jak i produkty, jest dokładnie taka sama..
Jest to zasadniczy wymóg dokładności wykonywanych obliczeń stechiometrycznych..
-Obliczenia
Krety wodne
Ile moli wody można wyprodukować podczas spalania 5 moli metanu z nadmiarem tlenu? Pokaż także, że prawo zachowania materii jest spełnione..
CH4 + 2 Odwa => COdwa + 2 godzdwaLUB
Obserwując zbilansowane równanie reakcji, można wyciągnąć wniosek, że 1 mol metanu wytwarza 2 mole wody.
Problem można rozwiązać bezpośrednio za pomocą prostego podejścia, ponieważ nie mamy 1 mola, ale 5 moli CH4:
Liczba moli wody = 5 moli CH4(2 mole H.dwaO / 1 mol CH4)
= 10
Co odpowiadałoby 180 g HdwaO. Powstało również 5 moli lub 220 g COdwa, co odpowiada całkowitej masie 400 g produktów.
Zatem, aby prawo zachowania materii zostało spełnione, 400 g odczynników musi zareagować; nie więcej nie mniej. Z tych 400 g 80 g odpowiada 5 molom CH4 (pomnożenie przez jego masę cząsteczkową 16 g / mol) i 320 g na 10 moli Odwa (podobnie dla jego masy cząsteczkowej 32 g / mol).
Spalanie wstęgi magnezowej
Wstęgę magnezu o wadze 1,50 g spalono w zamkniętym pojemniku zawierającym 0,80 g tlenu. Po spaleniu w pojemniku pozostało 0,25 g tlenu. a) Jaka masa tlenu przereagowała? b) Ile utworzyło się tlenku magnezu?
Masę tlenu, który przereagował, uzyskuje się przez prostą różnicę.
Masa zużytego tlenu = (masa początkowa - masa resztkowa) tlenu
= 0,80 g - 0,25 g
= 0,55 g Odwa (do)
Zgodnie z prawem zachowania masy,
Masa tlenku magnezu = masa magnezu + masa tlenu
= 1,50 g + 0,55 g
= 2,05 g MgO (b)
Prawo określonych proporcji
Joseph Louis Proust (1754-1826), francuski chemik, zdał sobie sprawę, że w reakcji chemicznej pierwiastki chemiczne zawsze reagują w ustalonych proporcjach mas, tworząc związek czysty konkretny; w związku z tym jego skład jest stały, niezależnie od źródła lub pochodzenia, czy też sposobu syntezy.
Proust w 1799 roku ogłosił prawo o określonych proporcjach, które głosi, że: „Kiedy dwa lub więcej pierwiastków łączy się w związek, robią to w ustalonym stosunku masowym”. Wtedy ta zależność jest ustalona i nie zależy od przyjętej strategii przygotowania związku..
Prawo to jest również znane jako prawo stałego składu, które mówi, że: „Każdy związek chemiczny w stanie czystości zawiera zawsze te same pierwiastki w stałej proporcji masy”..
-Ilustracja prawa
Żelazo (Fe) reaguje z siarką (S), tworząc siarczek żelaza (FeS), można zauważyć trzy sytuacje (1, 2 i 3):
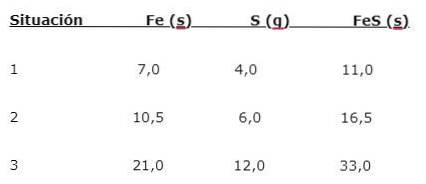
Aby znaleźć proporcję, w jakiej łączą się pierwiastki, podziel większą masę (Fe) przez mniejszą masę (S). Obliczenie daje stosunek 1,75: 1. Wartość tę powtarza się w trzech podanych warunkach (1, 2 i 3), w których uzyskuje się tę samą proporcję, chociaż stosuje się różne masy..
Oznacza to, że 1,75 g Fe łączy się z 1,0 g S, otrzymując 2,75 g FeS.
-Aplikacje
Stosując to prawo, można dokładnie poznać masy pierwiastków, które należy połączyć, aby uzyskać żądaną masę związku..
W ten sposób można uzyskać informacje o nadmiarze masy któregokolwiek z pierwiastków biorących udział w reakcji chemicznej lub o obecności w reakcji odczynnika ograniczającego..
Ponadto służy do poznania setnego składu związku, a na podstawie tego ostatniego można ustalić wzór związku.
Stuletni skład związku
Dwutlenek węgla (COdwa) powstaje w następującej reakcji:
C + Odwa => COdwa
12 g węgla łączy się z 32 g tlenu i daje 44 g dwutlenku węgla.
Więc procent węgla jest równy
Procent węgla = (12 g / 44 g) 100%
= 27,3%
Procent tlenu = (32 g / 44 g) 100%
Procent tlenu = 72,7%
Korzystając ze stwierdzenia prawa stałego składu, można zauważyć, że dwutlenek węgla zawsze składa się z 27,3% węgla i 72,7% tlenu..
-Obliczenia
Trójtlenek siarki
Gdy 4 g i 6 g siarki (S) poddano reakcji z tlenem (O) w różnych naczyniach, 10 g i 15 g trójtlenku siarki (SO3).
Dlaczego uzyskano takie ilości trójtlenku siarki, a nie inne?
Oblicz również ilość siarki wymaganą do połączenia z 36 g tlenu i masą otrzymanego trójtlenku siarki.
Część A)
W pierwszym pojemniku 4 siarkę miesza się z X g tlenu, uzyskując 10 g trójtlenku. Jeśli zastosujemy prawo zachowania masy, możemy obliczyć masę tlenu połączoną z siarką.
Masa tlenu = 10 g trójtlenku tlenu - 4 g siarki.
= 6 g
W zbiorniku 2 6 g siarki miesza się z X g tlenu, aby otrzymać 15% trójtlenku siarki.
Masa tlenu = 15 g trójtlenku siarki - 6 g siarki
= 9 g
Następnie przystępujemy do obliczania współczynników O / S dla każdego pojemnika:
Stosunek O / S w sytuacji 1 = 6 g O / 4 g S.
= 1,5 / 1
Stosunek O / S w sytuacji 2 = 9 g O / 6 g S.
= 1,5 / 1
Co jest zgodne z tym, co jest zapisane w prawie określonych proporcji, które wskazuje, że pierwiastki zawsze łączą się w tej samej proporcji, tworząc pewien związek..
W związku z tym uzyskane wartości są prawidłowe i te, które odpowiadają stosowaniu Prawa.
Część b)
W poprzednim podrozdziale obliczono wartość wskaźnika O / S na poziomie 1,5 / 1.
g siarki = 36 tlenu (1 g siarki / 1,5 g tlenu)
= 24 g
g trójtlenku siarki = 36 g tlenu + 24 g siarki
= 60 g
Chlor i magnez
Chlor i magnez są połączone w proporcji 2,95 g chloru na każdy gram magnezu. a) Określić masy chloru i magnezu niezbędne do uzyskania 25 g chlorku magnezu. b) Jaki jest skład procentowy chlorku magnezu?
Część A)
Opierając się na wartości 2,95 dla stosunku Cl: Mg, można przyjąć następujące podejście:
2,95 g Cl + 1 g Mg => 3,95 g MgCldwa
Później:
g Cl = 25 g MgCldwa (2,95 g Cl / 3,95 g MgCldwa)
= 18,67
g Mg = 25 g MgCldwa (1 g Mg / 3,95 g MgCldwa)
= 6,33
Tak więc 18,67 g chloru łączy się z 6,33 g magnezu, uzyskując 25 g chlorku magnezu..
Część b)
Najpierw obliczyć masę cząsteczkową chlorku magnezu, MgCldwa:
Masa cząsteczkowa MgCldwa = 24,3 g / mol + (2 35,5 g / mol)
= 95,3 g / mol
Procent magnezu = (24,3 g / 95,3 g) x 100%
= 25,5%
Procent chloru = (71 g / 95,3 g) x 100%
= 74,5%
Prawo proporcji wielokrotnych lub prawo Daltona
Prawo zostało ogłoszone w 1803 roku przez francuskiego chemika i meteorologa Johna Daltona na podstawie jego obserwacji dotyczących reakcji gazów atmosferycznych.
Prawo zostało sformułowane w następujący sposób: „Kiedy elementy są łączone, aby dać więcej niż jeden związek, zmienna masa jednego z nich łączy się ze stałą masą drugiego, a pierwszy ma jako relację liczb kanonicznych i niewyraźnych”.
Ponadto: „Kiedy dwa pierwiastki są łączone w celu utworzenia różnych związków, przy danej stałej ilości jednego z nich, różne ilości drugiego pierwiastka, które łączą się ze wspomnianą ustaloną ilością w celu wytworzenia związków, są odniesione do prostych liczb całkowitych”.
John Dalton dokonał pierwszego współczesnego opisu atomu jako składnika pierwiastków chemicznych, wskazując, że pierwiastki te składają się z niepodzielnych cząstek zwanych atomami..
Ponadto postulował, że związki powstają, gdy atomy różnych pierwiastków łączą się ze sobą w prostych stosunkach całkowitych..
Dalton zakończył prace śledcze Prousta. Wskazał na istnienie dwóch tlenków cyny, z zawartością 88,1% i 78,7% cyny i odpowiednio tlenu 11,9% i 21,3%..
-Obliczenia
Woda i nadtlenek wodoru
Pokaż, że związki woda, H.dwaO i nadtlenek wodoru, H.dwaLUBdwa, przestrzegać Prawa Wielorakich Proporcji.
Masy atomowe pierwiastków: H = 1 g / mol i tlen = 16 g / mol.
Masy cząsteczkowe związków: H.dwaO = 18 g / mol i H.dwaLUBdwa = 34 g / mol.
Wodór to pierwiastek o stałej zawartości w H.dwaO i H.dwaLUBdwa, tak więc proporcje między O i H w obu związkach zostaną ustalone.
Stosunek O / H w H.dwaO = (16 g / mol) / (2 g / mol)
= 8/1
Stosunek O / H w H.dwaLUBdwa = (32 g / mol) / (2 g / mol)
= 16/1
Zależność między obydwoma proporcjami = (16/1) / (8/1)
= 2
Zatem stosunek O / H nadtlenku wodoru do wody wynosi 2, prostą liczbę całkowitą. Dlatego wykazano zgodność z prawem wielokrotnych proporcji..
Tlenki azotu
Jaka masa tlenu łączy się z 3,0 g azotu w a) tlenku azotu, NO i b) dwutlenku azotu, NOdwa. Pokaż, że NIE i NIEdwa przestrzegać Prawa Wielorakich Proporcji.
Masa azotu = 3 g
Masy atomowe: azot 14 g / mol i tlen 16 g / mol.
Obliczenia
W NO, jeden atom N łączy się z 1 atomem O, więc masę tlenu łączącą się z 3 g azotu można obliczyć stosując następujące podejście:
g O = g azotu · (PA. O / PA. N)
= 3 g (16 g / mol / 14 g / mol)
= 3,43 g O
W NIEdwa, jeden atom N łączy się z 2 atomami O, więc masa połączonego tlenu wynosi:
g tlenu = 3 g (32 g / mol / 14 g / mol)
= 6,86 g O
Stosunek O / N w NO = 3,43 g O / 3 g N
= 1,143
Stosunek O / N w NOdwa = 6,86 g O / 3 g N
= 2282
Wartość relacji między proporcjami O / N = 2282/1143
= 2
Zatem wartość stosunku O / N wynosi 2, jest to prosta liczba całkowita. Dlatego Prawo wielokrotnych proporcji jest spełnione..
Prawo wzajemnych proporcji
To prawo, sformułowane osobno przez Richtera i Carla F. Wenzela, stanowi, że proporcje masowe dwóch związków ze wspólnym pierwiastkiem pozwalają określić proporcje trzeciego związku wśród innych pierwiastków, jeśli reagują.
Na przykład, jeśli masz dwa związki AB i CB, możesz zobaczyć, że wspólnym elementem jest B..
Prawo Richtera-Wenzela lub prawo wzajemnych proporcji mówi, że wiedząc, ile z A reaguje z B, aby dać AB, a ile z C reaguje z B, aby dać CB, możemy obliczyć masę A potrzebną do reakcji z masa C, aby utworzyć AC.
W rezultacie stosunek A: C lub A / C musi być wielokrotnością lub podwielokrotnością A / B lub C / B. Jednak prawo to nie zawsze jest spełnione, zwłaszcza gdy pierwiastki mają różne stopnie utlenienia..
Ze wszystkich rozważanych praw jest to chyba najbardziej „abstrakcyjne” lub skomplikowane. Ale jeśli przeanalizuje się go z matematycznego punktu widzenia, zobaczymy, że składa się tylko z współczynników konwersji i anulowań.
-Przykłady
Metan
Jeśli wiadomo, że 12 g węgla reaguje z 32 g tlenu, tworząc dwutlenek węgla; i że z drugiej strony 2 g wodoru reaguje z 16 g tlenu tworząc wodę, wówczas można oszacować proporcje masowe C / O i H / O dla COdwa i HdwaAlbo odpowiednio.
Obliczając C / O i H / O mamy:
C / O = 12 g C / 32 g O
= 3/8
H / O = 2g H / 16g O
= 1/8
Tlen jest powszechnym pierwiastkiem i chcesz wiedzieć, ile węgla reaguje z wodorem, aby wytworzyć metan; to znaczy, chcesz obliczyć C / H (lub H / C). Następnie konieczne jest dokonanie podziału poprzednich proporcji, aby wykazać, czy wzajemność jest spełniona:
C / H = (C / O) / (H / O)
Zauważ, że w ten sposób O są anulowane, a C / H pozostaje:
C / H = (3/8) / (1/8)
= 3
A 3 to wielokrotność 3/8 (3/8 x 8). Oznacza to, że 3 g C reaguje z 1 g H, dając metan. Ale żeby móc porównać to z COdwa, pomnóż C / H przez 4, co równa się 12; daje to 12 g C, który reaguje z 4 g H, tworząc metan, co również jest prawdą.
Siarczek magnezu
Jeśli wiadomo, że 24 g magnezu reaguje z 2 g wodoru, tworząc wodorek magnezu; i że dodatkowo 32 g siarki reaguje z 2 g wodoru tworząc siarkowodór, wspólnym pierwiastkiem jest wodór i chcemy obliczyć Mg / S z Mg / H i H / S.
Następnie licząc oddzielnie Mg / H i H / S otrzymujemy:
Mg / H = 24g Mg / 2g H
= 12
H / S = 2g H / 32g S.
= 1/16
Jednak wygodnie jest użyć S / H do anulowania H. Dlatego S / H jest równe 16. Po wykonaniu tej czynności przystępujemy do obliczania Mg / S:
Mg / S = (Mg / H) / (S / H)
= (12/16)
= 3/4
3/4 to podwielokrotność liczby 12 (3/4 x 16). Stosunek Mg / S wskazuje, że 3 g Mg reaguje z 4 g siarki, tworząc siarczek magnezu. Musisz jednak pomnożyć Mg / S przez 8, aby móc go porównać z Mg / H. Zatem 24 g Mg reaguje z 32 g siarki, dając ten siarczek metalu.
Chlorek glinu
Wiadomo, że 35,5 g Cl reaguje z 1 g H, tworząc HCl. Podobnie 27 g Al reaguje z 3 g H tworząc AlH3. Oblicz zawartość chlorku glinu i powiedz, czy taki związek jest zgodny z prawem Richtera-Wenzela.
Ponownie przystępujemy do obliczania oddzielnie Cl / H i Al / H:
Cl / H = 35,5 g Cl / 1 g H
= 35,5
Al / H = 27g Al / 3g H
= 9
Teraz oblicza się Al / Cl:
Al / Cl = (Al / H) / (Cl / H)
= 9 / 35,5
≈ 0,250 lub 1/4 (właściwie 0,253)
Oznacza to, że 0,250 g Al reaguje z 1 g Cl, tworząc odpowiednią sól. Ale znowu, Al / Cl należy pomnożyć przez liczbę, która pozwala na porównanie (dla wygody) z Al / H.
Niedokładności obliczeń
Następnie Al / Cl mnoży się przez 108 (27 / 0,250), otrzymując 27 g Al, który reaguje z 108 g Cl. Nie jest to dokładnie tak. Jeśli weźmiemy na przykład wartość 0,253 razy Al / Cl i pomnożymy ją przez 106,7 (27 / 0,253), otrzymamy, że 27 g Al reaguje z 106,7 g Cl; co jest bliższe rzeczywistości (AlCl3, z PA 35,5 g / mol dla Cl).
Oto, jak prawo Richtera może zacząć słabnąć z powodu precyzji i niewłaściwego użycia ułamków dziesiętnych..
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Flores, J. Química (2002). Od redakcji Santillana.
- Joaquín San Frutos Fernández. (s.f.). Prawa rozważne i objętościowe. Odzyskany z: encina.pntic.mec.es
- Toppr. (s.f.). Prawa związków chemicznych. Odzyskany z: toppr.com
- Znakomity. (2019). Prawa związków chemicznych. Odzyskany z: brilliant.org
- Chemia LibreTexts. (15 lipca 2015). Podstawowe prawa chemiczne. Źródło: chem.libretexts.org
- Helmenstine, dr Anne Marie (18 stycznia 2019). Prawo zachowania masy. Pobrane z: thinkco.com


Jeszcze bez komentarzy