
Czynniki i konsekwencje denaturacji białek

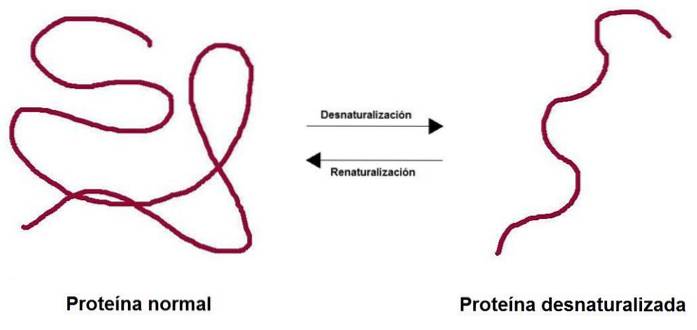
Plik denaturacja białek Polega na utracie trójwymiarowej struktury pod wpływem różnych czynników środowiskowych, takich jak temperatura, pH czy pewne czynniki chemiczne. Utrata struktury powoduje utratę funkcji biologicznej związanej z tym białkiem, m.in. enzymatycznej, strukturalnej, transporterowej..
Struktura białka jest bardzo wrażliwa na zmiany. Destabilizacja pojedynczego niezbędnego wiązania wodorowego może spowodować denaturację białka. Podobnie, istnieją interakcje, które nie są absolutnie niezbędne do pełnienia funkcji białka, a jeśli zostaną zdestabilizowane, nie mają wpływu na funkcję..
Indeks artykułów
- 1 Struktura białek
- 1.1 Struktura podstawowa
- 1.2 Struktura drugorzędna
- 1.3 Struktura trzeciorzędowa
- 1.4 Struktura czwartorzędowa
- 2 Czynniki powodujące denaturację
- 2,1 pH
- 2.2 Temperatura
- 2.3 Substancje chemiczne
- 2.4 Reduktory
- 3 konsekwencje
- 3.1 Renaturacja
- 4 Białka opiekuńcze
- 5 Referencje
Struktura białka
Aby zrozumieć procesy denaturacji białek, musimy wiedzieć, w jaki sposób są zorganizowane białka. Przedstawiają one strukturę pierwotną, drugorzędną, trzeciorzędową i czwartorzędową.
Struktura podstawowa
Jest to sekwencja aminokwasów, z których składa się to białko. Aminokwasy to podstawowe elementy budulcowe, z których składają się te biocząsteczki. Istnieje 20 różnych typów, z których każdy ma szczególne właściwości fizyczne i chemiczne. Wiążą się ze sobą poprzez wiązanie peptydowe.
Struktura drugorzędna
W tej strukturze ten liniowy łańcuch aminokwasów zaczyna się zwijać przez wiązania wodorowe. Istnieją dwie podstawowe struktury wtórne: helisa α o spiralnym kształcie; i złożony arkusz β, gdy dwa liniowe łańcuchy są ustawione równolegle.
Struktura trzeciorzędowa
Obejmuje inne rodzaje sił, które powodują określone fałdy trójwymiarowego kształtu.
Łańcuchy R reszt aminokwasowych, które tworzą strukturę białka, mogą tworzyć mostki dwusiarczkowe, a hydrofobowe części białek zlepiają się ze sobą wewnątrz, podczas gdy hydrofilowe są skierowane w stronę wody. Siły van der Waalsa działają jako stabilizator opisanych interakcji.
Struktura czwartorzędowa
Składa się z agregatów jednostek białkowych.
Kiedy białko ulega denaturacji, traci swoją czwartorzędową, trzeciorzędową i drugorzędową strukturę, podczas gdy pierwotna pozostaje nienaruszona. Białka bogate w wiązania dwusiarczkowe (struktura trzeciorzędowa) zapewniają większą odporność na denaturację.
Czynniki powodujące denaturację
Każdy czynnik destabilizujący wiązania niekowalencyjne odpowiedzialne za utrzymanie natywnej struktury białka może powodować jego denaturację. Wśród najważniejszych możemy wymienić:
pH
Przy bardzo skrajnych wartościach pH, zarówno kwaśnych, jak i zasadowych, białko może stracić swoją trójwymiarową konfigurację. Nadmiar jonów H.+ i OH- w środku destabilizuje interakcje białek.
Ta zmiana wzoru jonowego powoduje denaturację. Denaturacja przez pH może być w niektórych przypadkach odwracalna, aw innych nieodwracalna.
Temperatura
Denaturacja termiczna następuje wraz ze wzrostem temperatury. W organizmach żyjących w przeciętnych warunkach środowiskowych białka zaczynają destabilizować się w temperaturach powyżej 40 ° C. Oczywiście białka organizmów ciepłolubnych mogą wytrzymać te zakresy temperatur..
Wzrost temperatury przekłada się na zwiększone ruchy cząsteczek, które wpływają na wiązania wodorowe i inne wiązania niekowalencyjne, powodując utratę struktury trzeciorzędowej..
Te wzrosty temperatury prowadzą do zmniejszenia szybkości reakcji, jeśli mówimy o enzymach.
Substancje chemiczne
Substancje polarne - takie jak mocznik - w wysokich stężeniach wpływają na wiązania wodorowe. Podobnie substancje niepolarne mogą mieć podobne konsekwencje..
Detergenty mogą również destabilizować strukturę białka; nie jest to jednak agresywny proces i są one przeważnie odwracalne.
Środki redukujące
Β-Merkaptoetanol (HOCH2CH2SH) jest środkiem chemicznym często używanym w laboratorium do denaturacji białek. Odpowiada za redukcję mostków dwusiarczkowych między resztami aminokwasów. Może destabilizować trzeciorzędową lub czwartorzędową strukturę białka.
Innym środkiem redukującym o podobnych funkcjach jest ditiotreitol (DTT). Ponadto innymi czynnikami, które przyczyniają się do utraty natywnej struktury białek, są metale ciężkie w wysokich stężeniach oraz promieniowanie ultrafioletowe..
Konsekwencje
Kiedy dochodzi do denaturacji, białko traci swoją funkcję. Białka funkcjonują optymalnie w swoim rodzimym stanie.
Utrata funkcji nie zawsze wiąże się z procesem denaturacji. Może się zdarzyć, że niewielka zmiana w strukturze białka prowadzi do utraty funkcji bez destabilizacji całej trójwymiarowej struktury.
Proces może być nieodwracalny lub nie. W laboratorium, jeśli warunki ulegną odwróceniu, białko może powrócić do swojej początkowej konfiguracji.
Renaturacja
Jeden z najbardziej znanych i rozstrzygających eksperymentów nad renaturacją został potwierdzony w rybonukleazie A.
Gdy naukowcy dodali środki denaturujące, takie jak mocznik lub β-merkaptoetanol, białko uległo denaturacji. Gdyby te czynniki zostały usunięte, białko powróciło do swojej natywnej konformacji i mogłoby pełnić swoją funkcję ze 100% skutecznością..
Jednym z najważniejszych wniosków z tych badań było wykazanie eksperymentalnie, że trójwymiarową konformację białka nadaje jego pierwotna struktura..
W niektórych przypadkach proces denaturacji jest całkowicie nieodwracalny. Na przykład, gdy gotujemy jajko, przykładamy ciepło do tworzących je białek (głównym jest albumina), biel nabiera jednolitego i białawego wyglądu. Intuicyjnie możemy stwierdzić, że nawet jeśli go ostudzimy, nie wróci do swojej pierwotnej formy.
W większości przypadków procesowi denaturacji towarzyszy utrata rozpuszczalności. Zmniejsza również lepkość, szybkość dyfuzji i łatwiej krystalizuje..
Białka opiekuńcze
Białka opiekuńcze lub chaperoniny są odpowiedzialne za zapobieganie denaturacji innych białek. Tłumią również pewne interakcje, które nie są odpowiednie między białkami, aby zapewnić ich prawidłowe fałdowanie..
Gdy temperatura pożywki wzrasta, białka te zwiększają swoje stężenie i działają zapobiegając denaturacji innych białek. Dlatego też nazywane są „białkami szoku cieplnego” lub HSP od angielskiego akronimu. (Białka szoku cieplnego).
Chaperoniny są analogiczne do klatki lub beczki, która chroni interesujące białko w środku.
Te białka, które reagują na sytuacje stresu komórkowego, zostały opisane w różnych grupach organizmów żywych i są wysoce konserwatywne. Istnieją różne klasy chaperonin, które klasyfikuje się według ich masy cząsteczkowej..
Bibliografia
- Campbell, N. A. i Reece, J. B. (2007). biologia. Panamerican Medical Ed..
- Devlin, T. M. (2004). Biochemistry: Podręcznik z zastosowaniami klinicznymi. Wywrócony.
- Koolman, J. i Röhm, K. H. (2005). Biochemia: tekst i atlas. Panamerican Medical Ed..
- Melo, V., Ruiz, V. M. i Cuamatzi, O. (2007). Biochemia procesów metabolicznych. Przywróć.
- Pacheco, D., & Leal, D. P. (2004). Biochemia medyczna. Redakcja Limusa.
- Pena, A., Arroyo, A., Gómez, A. i Tapia, R. (1988). Biochemia. Redakcja Limusa.
- Sadava, D. i Purves, W. H. (2009). Life: The Science of Biology. Panamerican Medical Ed..
- Tortora, G. J., Funke, B. R. i Case, C. L. (2007). Wprowadzenie do mikrobiologii. Panamerican Medical Ed..
- Voet, D., Voet, J. G. i Pratt, C. W. (2007). Podstawy biochemii. Panamerican Medical Ed..



Jeszcze bez komentarzy