
Części i przykłady równań chemicznych

Plik równanie chemiczne jest to schematyczne przedstawienie niektórych charakterystyk reakcji chemicznej. Można również powiedzieć, że równanie chemiczne opisuje zmiany, jakich doświadczają różne substancje biorące udział w reakcji.
Wzory i symbole różnych uczestniczących substancji są umieszczone w równaniu chemicznym, wyraźnie wskazując liczbę atomów każdego pierwiastka obecnego w związkach, który pojawia się jako indeks dolny i nie można go zmienić poprzez zrównoważenie równania.
Równanie chemiczne musi wyglądać na zrównoważone, to znaczy liczba atomów zarówno reagentów, jak i produktów musi być równa. W ten sposób przestrzegane jest prawo zachowania materii. Pożądane jest, aby liczby używane do równoważenia równań były liczbami całkowitymi.
Równania te nie ujawniają kolejnych etapów ani mechanizmów przekształcania reagentów w produkty..
Dlatego, chociaż są one bardzo przydatne do zrozumienia, dokąd zmierza reakcja chemiczna, nie pozwalają nam zrozumieć jej molekularnych aspektów ani wpływu pewnych zmiennych; takie jak pH, lepkość, czas reakcji, prędkość mieszania, między innymi.
Indeks artykułów
- 1 Części równania chemicznego
- 1.1 Lokalizacja odczynników i produktów
- 1.2 Bilansowanie równań chemicznych
- 1.3 Stany fizyczne składników równania chemicznego
- 1.4 Zmiany stanu fizycznego
- 2 Przykładowe równania chemiczne
- 2.1 - Fotosynteza
- 2.2 - Oddychanie komórkowe
- 2.3 - Reakcje wspólnych elementów
- 3 Odnośniki
Części równania chemicznego
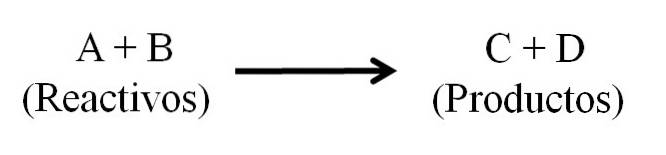
Istnieją zasadniczo trzy główne części równania chemicznego: reagenty, produkty i strzałka wskazująca kierunek reakcji chemicznej..
Lokalizacja odczynników i produktów
Wszystkie substancje, które działają jako reagenty i wszystkie te, które są produktami, pojawiają się w równaniu chemicznym. Te grupy substancji są oddzielone strzałką wskazującą kierunek reakcji. Odczynniki znajdują się po lewej stronie strzałki, a produkty po prawej stronie.
Strzałka oznacza to, co jest wytwarzane i jest zorientowana od lewej do prawej (→), chociaż w reakcjach odwracalnych istnieją dwie równoważne i równoległe strzałki; jeden skierowany w prawo, a drugi w lewo. Symbol (Δ) jest zwykle umieszczony nad strzałką, wskazując, że w reakcji użyto ciepła..
Ponadto identyfikacja katalizatora jest zwykle umieszczana na strzałce, jeśli to możliwe, z jego formułą lub symbolem. Różne substancje, które pojawiają się jako reagenty, są oddzielone znakiem (+), wskazującym, że substancje reagują lub łączą się ze sobą.
W przypadku substancji, które pojawiają się jako produkty, znak (+) nie ma poprzedniej konotacji; chyba że reakcja jest odwracalna. Dogodne jest, aby znak (+) był umieszczony w równej odległości od substancji, które oddziela.
Bilansowanie równań chemicznych
Zasadniczym wymaganiem jest, aby równania chemiczne były odpowiednio zbilansowane. W tym celu umieszcza się liczbę zwaną współczynnikiem stechiometrycznym. W razie potrzeby współczynnik ten musi poprzedzać substancje, które pojawiają się jako reagenty lub produkty..
Ma to na celu osiągnięcie tego, że liczba wszystkich atomów pierwiastków, które pojawiają się jako reagenty, jest dokładnie równa liczbie ich występujących w produkcie. Najprostszą metodą równoważenia równań chemicznych jest metoda prób i błędów..
Stany fizyczne składników równania chemicznego
W niektórych równaniach chemicznych stan skupienia substancji jest oznaczony indeksem dolnym. W tym celu w języku hiszpańskim stosuje się następujące skróty: (s) dla ciała stałego; l) dla stanu płynnego; g) stan gazowy; i (ac), wodny roztwór.
Przykład: reakcja węglanu wapnia z kwasem solnym.
Złodziej3 (s) + 2 HCl(ac) → CaCl2 (s) + H.dwaLUB(l) + WSPÓŁ2 g)
Zmiany stanu fizycznego
W niektórych przypadkach w równaniu chemicznym wskazuje się, czy w reakcji chemicznej ma miejsce produkcja gazu lub czy występuje wytrącanie którejkolwiek z wytworzonych substancji.
Na obecność gazu wskazuje pionowa strzałka skierowana końcem do góry (↑), umieszczona po prawej stronie substancji gazowej.
Przykład: reakcja cynku z kwasem solnym.
Zn + 2 HCl → ZnCldwa + H.dwa↑
Jeżeli w reakcji chemicznej jedna z substancji utworzy osad, jest to symbolizowane przez umieszczenie pionowej strzałki skierowanej końcem w dół (↓), umieszczonej po prawej stronie wytrąconej substancji..
Przykład: reakcja kwasu solnego z azotanem srebra.
HCl + AgNO3 → HNO3 + AgCl ↓
Przykładowe równania chemiczne
- Fotosynteza

Fotosynteza to proces, w którym rośliny wychwytują i przekształcają energię świetlną pochodzącą ze światła słonecznego w celu wytworzenia energii niezbędnej do ich przetrwania. Fotosynteza jest przeprowadzana przez niektóre organelle komórek roślinnych zwane chloroplastami.
Tylakoidy znajdują się w błonie chloroplastowej, w miejscach, w których znajdują się chlorofile. do Y b, które są głównymi pigmentami, które wychwytują energię świetlną.
Chociaż fotosynteza jest złożonym procesem, można go opisać następującym równaniem chemicznym:
6 COdwa + 6 godzdwaO → C6H.12LUB6 + 6 Odwa↑ ΔGº = 2870 kJ / mol
do6H.12LUB6 Jest to wzór na glukozę, węglowodan metabolizowany do produkcji ATP; związek, który jest głównym rezerwuarem energii w większości żywych istot. Ponadto NADPH jest wytwarzany z glukozy, koenzymu niezbędnego w wielu reakcjach..
- Oddychania komórkowego
Komórki wykorzystują tlen do metabolizmu wielu substancji obecnych w spożywanym pożywieniu. Tymczasem ATP jest wykorzystywane jako źródło energii dla czynności wykonywanych przez istoty żywe, wytwarzając w tych procesach dwutlenek węgla i wodę..
Jeżeli jako model dla metabolizowanej substancji stosowana jest glukoza, oddychanie można określić schematycznie za pomocą następującego równania chemicznego:
do6H.12LUB6 + 6 Odwa → 6 COdwa + 6 godzdwaLUB
- Typowe reakcje na elementy
Reakcja rozkładu
Związek lub związki dysocjują, tworząc inne różne związki z ich atomami:
2 KClO3 (s) → 2 KCl(s) + 3 O2 g)
Reakcja przemieszczenia
Metal reaguje ze związkiem, zastępując obecny w nim metal:
Mg(s) + KIERUNEK4 (ac) → Cu(s) + MgSO4 (ac)
Reakcja eliminacji
W tego typu reakcji zmniejsza się liczba atomów lub grup przyłączonych do atomu węgla:
CH3-CHdwaBr + NaOH → HdwaC = CHdwa + H.dwaO + NaBr
Reakcja hydratacji
Jest to reakcja, w której związek dodaje cząsteczkę wody. Ta reakcja jest ważna przy wytwarzaniu alkoholi:
H.dwaC = CHdwa + H.dwaO → H.dwaC-CHdwaO
Reakcja neutralizacji
Zasada lub zasada reaguje z kwasem, tworząc sól i wodę:
HCl(ac) + NaOH(ac) → NaCl(ac) + H.dwaLUB(l)
Reakcja syntezy
W tego typu reakcji dwie lub więcej substancji łączy się w celu utworzenia nowego związku:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Reakcja podwójnego wypierania (metateza)
W tego typu reakcji dochodzi do wymiany jonów dodatnich i ujemnych w celu utworzenia nowych związków:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Starszy brat3 (ac)
Bibliografia
- Flores, J. (2002). Chemia. Edycja 1to było. Od redakcji Santillana
- Mathews, C. K., Van Holde, K. E., and Ahern, K. G. (2002). Biochemia. 3to było Wydanie. Wydawca Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2019). Równanie chemiczne. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (20 września 2019). Co to jest równanie chemiczne? Odzyskany z: thinkco.com


Jeszcze bez komentarzy