
Elektroujemność i różnica energii w skali Paulinga

Plik Skala Paulinga jest arbitralną skalą używaną w chemii do wyrażenia elektroujemność elementów. Definiuje się to jako skłonność określonego atomu do przyciągania elektronów w połączeniu z innym atomem.
W tym sensie pierwiastki o wysokiej elektroujemności mają tendencję do łatwego uzyskiwania elektronów. Są to niemetale, natomiast ze swojej strony mniej elektroujemnych pierwiastków, takich jak metale, łatwiej jest oddać elektrony.
Dlatego znając elektroujemność elementu, ma się pojęcie o typie wiązania, które jest w stanie utworzyć w połączeniu z innym. Zobaczymy to na przykładzie liczbowym później..
Dzięki tym informacjom można przewidzieć wiele właściwości, które będzie miał związek, co jest bardzo przydatne w chemii eksperymentalnej i materiałoznawstwie, gdzie nieustannie powstają nowe związki..
Jednak wygodnie jest wyjaśnić, że pomimo tego, jak ważne jest to, nie ma jednego sposobu na określenie elektroujemności; Skala Paulinga to tylko jeden z wielu proponowanych sposobów jej znalezienia, chociaż jest jednym z najczęściej używanych.
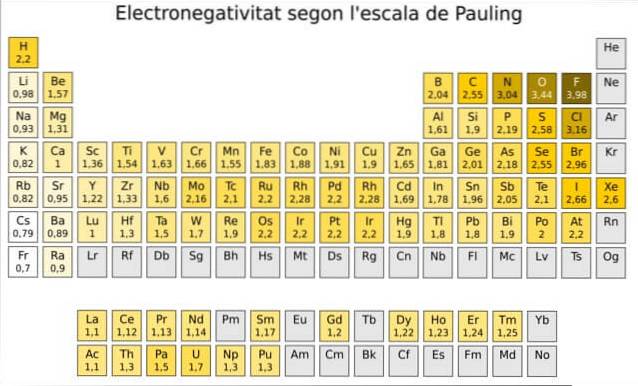
W rzeczywistości skala Paulinga jest arbitralną skalą, w której każdemu elementowi układu okresowego przypisywana jest wartość liczbowa, która odzwierciedla jego elektroujemność. Widzimy to na rysunku 1, gdzie mamy elektroujemność każdego elementu, przypisaną przez dwukrotnego laureata Nagrody Nobla Linusa Paulinga (1901-1994) około 1939 r..
Indeks artykułów
- 1 Elektroujemność pierwiastków
- 1.1 Elektroujemność w układzie okresowym
- 2 Różnica energii wiązania
- 2.1 Równania elektroujemności
- 3 Przykład
- 3.1 Rozwiązanie
- 4 Odnośniki
Elektroujemność pierwiastków
Pauling wraz z Donem M. Yostem ustalili empirycznie wartości elektroujemności na podstawie danych eksperymentalnych uzyskanych z pomiaru energii wiązań..
Pauling przypisał pierwiastkowi fluor - powyżej i po prawej stronie tabeli na rysunku 1 - najwyższą elektroujemność, o liczbie 4,0. Więc kiedy fluor tworzy wiązania, wykazuje największą tendencję do przyciągania elektronów ze wszystkich pierwiastków..
Drugi to tlen z 3,5, a trzeci to azot z 3,0. Obie znajdują się u góry i po prawej stronie stołu.
Z drugiej strony, na przeciwnym biegunie, najmniej elektroujemnym pierwiastkiem jest cez, którego symbolem jest Cs, znajdujący się po lewej stronie tabeli, któremu Pauling przypisał liczbę 0,7..
Elektroujemność w układzie okresowym
Ogólnie rzecz biorąc, i jak widać na rycinie 1, elektroujemność - i energia jonizacji - wzrasta od lewej do prawej w układzie okresowym. Ogólny trend wskazuje również na spadek przy przechodzeniu z góry na dół.
Dlatego w prawym górnym rogu tabeli będziemy mieli najbardziej elektroujemne pierwiastki: fluor, tlen, chlor, azot. Najmniej elektroujemny - lub najbardziej elektrododatni, jeśli wolisz - będzie znajdował się po lewej stronie: lit, sód, potas i inne pierwiastki z grupy 1 - kolumna po lewej stronie, odpowiadająca metalom alkalicznym i ziem alkalicznych.-.
W każdej kolumnie elektroujemność maleje wraz ze wzrostem liczby atomowej pierwiastka, z wyjątkiem metali przejściowych w środku, które nie podążają za tym trendem..
Ważną kwestią, na którą należy zwrócić uwagę, jest to, że elektroujemność jest względna, nie jest niezmienną właściwością każdego elementu i jest mierzona tylko w odniesieniu do innych pierwiastków. Zależy to w dużej mierze od stopnia utlenienia, więc ten sam pierwiastek może wykazywać różną elektroujemność, w zależności od rodzaju tworzonego związku..
Różnica energii wiązania

W chemii wiązanie to sposób, w jaki atomy, takie same lub różne, łączą się ze sobą, tworząc cząsteczki. Pomiędzy atomami pojawiają się siły, które utrzymują je razem w stabilny sposób.
Istnieje kilka rodzajów linków, ale pod uwagę brane są dwa:
-Kowalencyjne, w którym atomy o podobnych elektroujemnościach mają wspólną parę elektronów.
-Jonowy, częsty między atomami o różnych elektroujemnościach, w których dominuje przyciąganie elektrostatyczne.
Załóżmy, że dwa elementy A i B mogą tworzyć ze sobą cząsteczki, oznaczone AA i BB. I że są również zdolne do łączenia się, tworząc związek AB, wszystko za pomocą pewnego rodzaju wiązania.
Dzięki udziałowi sił międzycząsteczkowych w wiązaniu jest energia. Na przykład energia w wiązaniu AA to E.AA, w wiązaniu BB jest to EBB, a na końcu w związku AB jest to EAB.
Jeśli cząsteczka AB została utworzona przez wiązanie kowalencyjne, teoretycznie energia wiązania jest średnią energii EAA i E.nocleg ze śniadaniem:
IAB = ½ (E.AA + Inocleg ze śniadaniem)
Pauling obliczył E.AB dla różnych związków zmierzył to eksperymentalnie i określił różnicę między obiema wartościami, które nazwał Δ:
Δ = | (E.AB) mierzone - (E.AB) teoretyczne | = | (E.AB) mierzone - ½ (E.AA + Inocleg ze śniadaniem) |
Pauling rozumował w ten sposób: jeśli Δ jest bardzo blisko 0, oznacza to, że elektroujemności obu pierwiastków są podobne, a wiązanie, które je łączy, jest kowalencyjne. Ale jeśli Δ nie jest małe, to wiązanie między A i B nie jest czysto kowalencyjne.
Im większa wartość bezwzględna Δ, tym większa różnica między elektroujemnością pierwiastków A i B, a zatem wiązanie, które je łączy, będzie typu jonowego. Później czytelnik znajdzie przykład, w którym obliczając Δ można określić rodzaj wiązania związku.
Równania na elektroujemność
Zakładając, że różnica energii jest sygnałem odróżniającym naturę wiązania, Pauling przeprowadził wiele eksperymentów, które doprowadziły go do stworzenia empirycznego wyrażenia dla względnych elektroujemności dwóch pierwiastków A i B, które tworzą cząsteczkę..
Oznaczając tę elektroujemność jako χ (grecka litera „chi”), Pauling zdefiniował Δ następująco:
fadwa· Δ = [χ (A) - χ (B)]dwa
χ (A) - χ (B) = f√Δ = 0,102√Δ
Zauważ, że Δ jest wartością dodatnią. Współczynnik f = 0,102, który pojawia się po pomnożeniu pierwiastka kwadratowego z Δ, jest współczynnikiem konwersji między kJ (kilodżulami) a eV (elektronowolt), obie jednostki energii.
Jeśli zamiast tego używa się kilokalorii i elektronowoltów, różnica w elektroujemności jest wyrażona za pomocą podobnego wzoru, ale przy f = 0,208:
χ (A) - χ (B) = 0,208√Δ
Pauling rozpoczął od przypisania wodoru wartości 2,1, poprzedniej wartości uzyskanej przez chemika Roberta Mullikena. Jako punkt wyjścia wybrał ten pierwiastek, ponieważ tworzy on wiązania kowalencyjne z wieloma innymi..
Korzystając z powyższego równania, kontynuował przypisywanie wartości względnych pozostałym elementom. W ten sposób zdał sobie sprawę, że elektroujemność wzrasta podczas przechodzenia od lewej do prawej i od góry do dołu w układzie okresowym, jak opisano w poprzedniej sekcji..
Przykład
Poniżej znajduje się lista pierwiastków: N, J, Y i M oraz ich odpowiednie elektroujemności Χ według skali Paulinga:
-N: Χ = 4,0
-jot: Χ = 1,5
-Y: Χ = 0,9
-M: Χ = 1,6
Wśród utworzonych z nimi związków:
YJ, YN, MN i JM
Wskaż ten o najwyższym charakterze jonowym i ten, którego natura jest kowalencyjna. Powód Twojej odpowiedzi.
Rozwiązanie
Zgodnie z kryteriami ustalonymi przez Paulinga, związek o największym charakterze jonowym będzie tym z największą różnicą między elektroujemnościami, a zatem większą wartością Δ. Z kolei związek o najmniejszej różnicy energii to związek z wiązaniem kowalencyjnym.
Następnie obliczymy, ile Δ jest warte dla każdego związku, w następujący sposób:
Kompozyt YJ
Δ = [χ (Y) - χ (J)]dwa = (0,9 - 1,5)dwa = 0,36
Kompozyt YN
Δ = [χ (Y) - χ (N)]dwa = (0,9 - 4,0)dwa = 9,61
Kompozyt MN
Δ = [χ (M) - χ (N)]dwa = (1,6 - 4,0)dwa = 5,76
Kompozytowe JM
Δ = [χ (J) - χ (M)]dwa = (1,5 - 1,6)dwa = 0,01
Z poprzednich wyników wynika, że związkiem jonowym jest YN, którego Δ = 9,61, natomiast związkiem kowalencyjnym jest JM, przy Δ = 0,01.
Bibliografia
- Chemistry Libretexts. Paulinga Elektroujemność. Źródło: chem.libretexts.org.
- Złota Księga IUPAC. Elektroujemność. Odzyskany z: goldbook.iupac.org.
- Salas-Banuet, G. Niezrozumiana elektroujemność. Odzyskany z: scielo.org.
- Teksty naukowe. Elektroujemność. Odzyskany z: textcientificos.com.
- Whitten, K. 2010. Chemia. 9. Ed. Brooks / Cole. Cengage Learning.
- Wikipedia. Wiązanie kowalencyjne. Odzyskane z: es.wikipedia.org.
- Wikipedia. Wiązanie jonowe. Odzyskane z: es.wikipedia.org.


Jeszcze bez komentarzy