
Charakterystyka ciała stałego, właściwości, rodzaje, przykłady

Plik stan stały jest to jeden z głównych sposobów dodawania materii w celu stworzenia skondensowanych lub stałych ciał. Cała skorupa ziemska, pomijając morza i oceany, jest pstrokatym konglomeratem ciał stałych. Przykładami obiektów w stanie stałym są książka, kamień lub ziarenka piasku.
Możemy wchodzić w interakcje z ciałami stałymi dzięki odpychaniu naszych elektronów z atomami lub cząsteczkami. W przeciwieństwie do cieczy i gazów, o ile nie są silnie toksyczne, nasze ręce nie mogą przez nie przejść, ale kruszą się lub wchłaniają.

Ciała stałe są na ogół znacznie łatwiejsze w obróbce lub przechowywaniu niż ciecz lub gaz. Dopóki jego cząstki nie zostaną drobno podzielone, prąd wiatru nie przeniesie go w inne kierunki; są utrwalone w przestrzeni określonej przez międzycząsteczkowe interakcje ich atomów, jonów lub cząsteczek.
Indeks artykułów
- 1 Pojęcie bryły
- 2 Ogólna charakterystyka ciał stałych
- 3 Właściwości
- 3.1 Temperatury topnienia
- 3.2 Stechiometria
- 3.3 Wady
- 3.4 Reaktywność
- 3.5 Fizyczne
- 4 Rodzaje i przykłady
- 4.1 Krystaliczne ciała stałe
- 4.2 Amorficzne ciała stałe
- 4.3 Ionic
- 4.4 Metaliczny
- 4.5 Atomic
- 4.6 Molekularne i polimerowe
- 4.7 Sieci kowalencyjne
- 5 Referencje
Solidna koncepcja
Ciało stałe jest stanem materii, w którym występuje sztywna objętość i kształt; cząsteczki tworzące materiały lub przedmioty w stanie stałym są unieruchomione w jednym miejscu, nie są łatwo ściśliwe.
Ten stan skupienia jest najbardziej zróżnicowany i bogaty pod względem chemicznym i fizycznym. Mamy jonowe, metaliczne, atomowe, molekularne i kowalencyjne ciała stałe, z których każda ma własną jednostkę strukturalną; to znaczy z własnymi kryształami. Kiedy ich sposób agregacji nie pozwala im na ustanowienie uporządkowanych struktur wewnętrznych, stają się amorficzne i zawiłe.
Badania stanu stałego są zbieżne w projektowaniu i syntezie nowych materiałów. Na przykład drewno, naturalne ciało stałe, zostało również użyte jako materiał ozdobny i do budowy domów.
Inne materiały stałe pozwalają na produkcję samochodów, samolotów, statków, statków kosmicznych, reaktorów jądrowych, artykułów sportowych, baterii, katalizatorów i wielu innych przedmiotów lub produktów..
Ogólna charakterystyka ciał stałych

Główne cechy ciał stałych to:
-Mają określoną masę, objętość i kształty. Na przykład gaz nie ma końca ani początku, ponieważ zależą one od pojemnika, w którym go przechowuje..
-Są bardzo gęste. Ciała stałe wydają się być gęstsze niż ciecze i gazy; chociaż jest kilka wyjątków od reguły, zwłaszcza przy porównywaniu cieczy i ciał stałych.
-Odległości, które oddzielają ich cząstki, są krótkie. Oznacza to, że były one bardzo spójne lub zwarte w odpowiedniej objętości.

-Ich interakcje międzycząsteczkowe są bardzo silne, w przeciwnym razie nie istniałyby jako takie i topiłyby się lub sublimowały w warunkach ziemskich..

-Ruchliwość ciał stałych jest zwykle dość ograniczona, nie tylko z materialnego punktu widzenia, ale także z molekularnego punktu widzenia. Jego cząsteczki są uwięzione w stałej pozycji, w której mogą tylko wibrować, ale nie mogą się poruszać ani obracać (w teorii).
Nieruchomości
Temperatury topnienia
Wszystkie ciała stałe, o ile nie ulegną rozkładowi w procesie i niezależnie od tego, czy są dobrymi przewodnikami ciepła, czy nie, mogą przejść w stan ciekły w określonej temperaturze: ich temperaturze topnienia. Kiedy ta temperatura zostanie osiągnięta, jego cząsteczki w końcu zdołają przepłynąć i uciec ze swoich ustalonych pozycji..
Ta temperatura topnienia będzie zależeć od natury ciała stałego, jego interakcji, masy molowej i energii sieci krystalicznej. Zasadniczo jonowe ciała stałe i sieci kowalencyjne (takie jak diament i dwutlenek krzemu) mają zwykle najwyższe temperatury topnienia; natomiast cząsteczki stałe najniższe.
Poniższy obraz pokazuje, jak kostka lodu (stan stały) zmienia się w stan ciekły:

Stechiometria
Wiele ciał stałych ma charakter molekularny, ponieważ są to związki, których interakcje międzycząsteczkowe pozwalają im łączyć się w taki sposób. Jednak wiele innych jest jonowych lub częściowo jonowych, więc ich jednostkami nie są cząsteczki, ale komórki: zestaw atomów lub jonów ułożonych w uporządkowany sposób..
To tutaj formuły takich ciał stałych muszą uwzględniać neutralność ładunków, wskazując ich skład i zależności stechiometryczne. Na przykład ciało stałe, którego hipotetyczny wzór to Adwab4LUBdwa zwraca uwagę, że ma taką samą liczbę atomów A jak O (2: 2), podczas gdy ma dwukrotnie większą liczbę atomów B (2: 4).
Zwróć uwagę, że indeksy dolne wzoru Adwab4LUBdwa są to liczby całkowite, co wskazuje, że jest to ciało stałe o charakterze stechiometrycznym. Te wzory opisują skład wielu ciał stałych. Ładunki A, B i O muszą sumować się równe zero, ponieważ w przeciwnym razie wystąpiłby ładunek dodatni lub ujemny.
W przypadku ciał stałych szczególnie przydatna jest umiejętność interpretacji ich wzorów, ponieważ na ogół skład cieczy i gazów jest prostszy.
Wady
Struktury brył nie są doskonałe; przedstawiają niedoskonałości lub defekty, niezależnie od tego, jak mogą być krystaliczne. Nie dotyczy to cieczy lub gazów. Nie ma obszarów wody w stanie ciekłym, co do których można z góry stwierdzić, że są „przemieszczone” w stosunku do otoczenia..
Takie wady są odpowiedzialne za to, że ciała stałe są twarde i kruche, wykazując takie właściwości jak piroelektryczność i piezoelektryczność lub przestają mieć określony skład; to znaczy są niestechiometrycznymi ciałami stałymi (na przykład A0,4b1.3LUB0.5).
Reaktywność
Ciała stałe są zwykle mniej reaktywne niż ciecze i gazy; ale nie z przyczyn chemicznych, ale z faktu, że ich struktura uniemożliwia reagentom atakowanie cząstek znajdujących się w ich wnętrzu, reagując najpierw z tymi na ich powierzchni. Dlatego reakcje z udziałem ciał stałych są zwykle wolniejsze; chyba że zostaną sproszkowane.
Kiedy ciało stałe jest w postaci proszku, jego mniejsze cząstki mają większą powierzchnię lub większą powierzchnię do reakcji. Dlatego drobne ciała stałe są często oznaczane jako potencjalnie niebezpieczne odczynniki, ponieważ mogą zapalić się szybko lub gwałtownie reagować w kontakcie z innymi substancjami lub związkami..
Substancje stałe są często rozpuszczane w środowisku reakcyjnym w celu ujednorodnienia układu i przeprowadzenia syntezy z wyższą wydajnością..
Fizyczny
Z wyjątkiem temperatury topnienia i defektów, to, co powiedziano dotychczas, bardziej odpowiada właściwościom chemicznym ciał stałych niż ich właściwościom fizycznym. Fizyka materiałów jest głęboko skupiona na tym, jak światło, dźwięk, elektrony i ciepło oddziałują z ciałami stałymi, niezależnie od tego, czy są one krystaliczne, amorficzne, molekularne itp..
Tutaj pojawia się coś, co jest znane jako plastyczne, elastyczne, sztywne, nieprzezroczyste, przezroczyste, nadprzewodzące, fotoelektryczne, mikroporowate, ferromagnetyczne, izolujące lub półprzewodnikowe..
Na przykład w chemii interesujące są materiały, które nie pochłaniają promieniowania ultrafioletowego lub światła widzialnego, ponieważ są używane do wykonywania ogniw pomiarowych do spektrofotometrów UV-Vis. To samo dzieje się z promieniowaniem podczerwonym, gdy chcesz scharakteryzować związek poprzez uzyskanie jego widma IR lub zbadać przebieg reakcji.
Badanie i manipulowanie wszystkimi właściwościami fizycznymi ciał stałych wymaga ogromnego poświęcenia, a także ich syntezy i projektowania, dobierając „kawałki” konstrukcji nieorganicznej, biologicznej, organicznej lub metaloorganicznej do nowych materiałów..
Rodzaje i przykłady
Ponieważ chemicznie istnieje kilka typów ciał stałych, dla każdego z nich zostaną wymienione reprezentatywne przykłady..
Krystaliczne ciała stałe
Z jednej strony istnieją krystaliczne ciała stałe. Elementy te charakteryzują się tym, że tworzące je cząsteczki są skonfigurowane w ten sam sposób, co jest powtarzane jako wzór w całym krysztale. Każdy wzór nazywany jest komórką elementarną.
Krystaliczne ciała stałe również charakteryzują się określoną temperaturą topnienia; Oznacza to, że biorąc pod uwagę jednorodność układu jego cząsteczek, istnieje taka sama odległość między każdą komórką elementarną, co pozwala całej strukturze na ciągłą transformację w tej samej temperaturze..
Przykładami krystalicznych ciał stałych mogą być sól i cukier..
Amorficzne ciała stałe
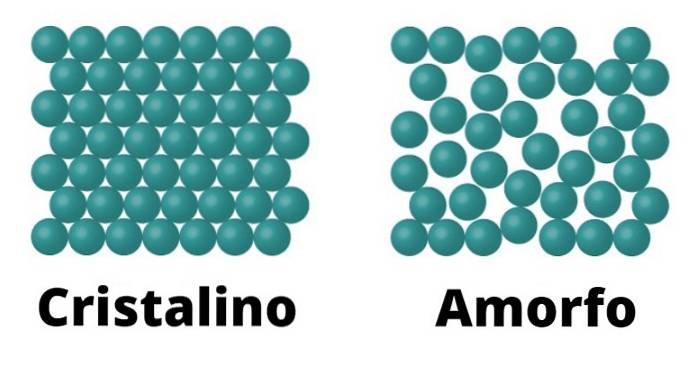
Amorficzne ciała stałe charakteryzują się tym, że konformacja ich cząsteczek nie odpowiada wzorowi, ale zmienia się na całej powierzchni.
Ponieważ nie ma takiego wzoru, temperatura topnienia amorficznych ciał stałych nie jest zdefiniowana, w przeciwieństwie do krystalicznych, co oznacza, że topi się stopniowo iw różnych temperaturach..
Przykładami amorficznych ciał stałych może być szkło i większość tworzyw sztucznych.
Joniki
Jonowe ciała stałe charakteryzują się tym, że zawierają kationy i aniony, które oddziałują ze sobą poprzez przyciąganie elektrostatyczne (wiązanie jonowe). Gdy jony są małe, powstałe struktury są zwykle zawsze krystaliczne (biorąc pod uwagę ich wady). Wśród niektórych jonowych ciał stałych mamy:
-NaCl (Na+Cl-), chlorek sodu
-MgO (Mgdwa+LUBdwa-), tlenek magnezu
-Złodziej3 (ACdwa+WSPÓŁ3dwa-), węglan wapnia
-KIERUNEK4 (Cudwa+południowy zachód4dwa-), siarczan miedzi
-KF (K+fa-), fluorek potasu
-NH4Cl (NH4+Cl-), chlorek amonu
-ZnS (Zndwa+Sdwa-), siarczek cynku
-Fe (C.6H.5GRUCHAĆ)3, benzoesan żelaza
Metaliczny
Jak wskazuje ich nazwa, są to ciała stałe, w których atomy metalu oddziałują poprzez metaliczne wiązanie:
-Srebro
-Złoto
-Prowadzić
-Mosiądz
-Brązowy
-białe złoto
-Stop cyny z ołowiem
-Stal
-Duraluminium
Zauważ, że stopy oczywiście również liczą się jako ciała stałe metaliczne.
Atomowy
Metaliczne ciała stałe są również atomami, ponieważ teoretycznie nie ma wiązań kowalencyjnych między atomami metalu (M-M). Jednak gazy szlachetne w istocie liczą się jako gatunki atomowe, ponieważ przeważają wśród nich tylko siły dyspersyjne Londynu..
Dlatego, chociaż nie są to ciała stałe o dużym zastosowaniu (i trudne do uzyskania), skrystalizowane gazy szlachetne są przykładami atomowych ciał stałych; tj .: hel, neon, argon, krypton itp., ciała stałe.
Molekularne i polimerowe
Cząsteczki mogą oddziaływać poprzez siły Van der Wallsa, gdzie ich masy cząsteczkowe, momenty dipolowe, wiązania wodorowe, struktury i geometrie odgrywają ważną rolę. Im silniejsze takie oddziaływania, tym większe prawdopodobieństwo, że będą miały postać ciała stałego.
Z drugiej strony to samo rozumowanie odnosi się do polimerów, które ze względu na wysoką średnią masę cząsteczkową są prawie zawsze ciałami stałymi, a kilka z nich jest amorficznych; ponieważ jej jednostki polimerowe mają trudności z ułożeniem się w celu tworzenia kryształów.
Tak więc mamy wśród niektórych molekularnych i polimerowych ciał stałych:
-Suchy lód

-Cukier
-Jod
-Kwas benzoesowy
-Acetamid
-Siarka rombowa
-Kwas palmitynowy
-Fulereny
-Mecz
-Kofeina
-Naftalen
-Drewno i papier
-Jedwab
-Teflon
-Polietylen
-Kevlar
-Bakelit
-Chlorek winylu
-Polistyren
-Polipropylen
-Białko
-Tabliczka czekolady
Sieci kowalencyjne
Wreszcie mamy sieci kowalencyjne między najtwardszymi i najwyżej topiącymi się ciałami stałymi. Oto kilka przykładów:
-Grafit
-Diament
-Kwarc
-Węglik krzemu
-Azotek boru
-Fosforek glinu
-Arsenku galu
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2019). Chemia ciała stałego. Odzyskane z: en.wikipedia.org
- Elsevier B.V. (2019). Chemia ciała stałego. ScienceDirect. Odzyskany z: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Uwagi do wykładów z chemii ciała stałego. Odzyskany z: unf.edu
- pytani. (2019). Ogólna charakterystyka ciała stałego. Odzyskany z: askiitians.com
- David Wood. (2019). Jak atomy i cząsteczki tworzą ciała stałe: wzory i kryształy. Nauka. Odzyskany z: study.com



Jeszcze bez komentarzy