
Struktura i funkcje fibronektyny

Plik fibronektyna Jest to klasa glikoprotein, która należy do macierzy zewnątrzkomórkowej. Ten typ białka jest na ogół odpowiedzialny za przyczepianie się lub wiązanie błony komórkowej z włóknami kolagenowymi znajdującymi się na zewnątrz.
Nazwa „fibronektyna” pochodzi od słowa składającego się z dwóch łacińskich słów, z których pierwsze to „błonnik" co oznacza włókno lub włókno, a drugi „Necter” co oznacza łączenie, łączenie, wklejanie lub wiązanie.
Fibronektyna została po raz pierwszy uwidoczniona w 1948 roku jako zanieczyszczenie fibrynogenu przygotowanego w procesie frakcjonowania zimnego etanolu Cohna. Zostało to zidentyfikowane jako unikalna glikoproteina osocza, która posiadała cechy zimnej nierozpuszczalnej globuliny..
Białko to ma dużą masę cząsteczkową i jest związane z wieloma różnymi funkcjami w tkankach. Należą do nich między innymi adhezja między komórką a komórką, organizacja cytoszkieletu, transformacja onkogenna..
Fibronektyna jest rozprowadzana do wielu miejsc w organizmie poprzez jej rozpuszczalną postać w osoczu krwi, płynie mózgowo-rdzeniowym, mazi stawowej, płynie owodniowym, płynie nasiennym, ślinie i wysiękach zapalnych..
Naukowcy donoszą, że stężenie fibronektyny w osoczu wzrasta, gdy kobiety w ciąży cierpią na stan przedrzucawkowy. Tak więc ten wzrost stężenia fibronektyny został uwzględniony przez specjalistów w celu zdiagnozowania tego stanu..
Indeks artykułów
- 1 Struktura
- 1.1 Dziedziny i właściwości „multi-adhezji”
- 2 Funkcje
- 3 Odnośniki
Struktura
Fibronektyny to duże glikoproteiny o masie cząsteczkowej około 440 kDa. Składają się z około 2300 aminokwasów, które stanowią 95% białka, ponieważ pozostałe 5% to węglowodany.
Różne analizy, które zostały przeprowadzone na sekwencji genomowej i transkryptomicznej (informacyjnym RNA) białka wykazały, że składa się ono z trzech bloków powtarzających się sekwencji homologicznych, każdy o długości 45, 60 i 90 aminokwasów..
Te trzy typy sekwencji stanowią ponad 90% całkowitej struktury fibronektyn. Homologiczne sekwencje typu I i II są pętlami połączonymi ze sobą mostkami dwusiarczkowymi. Każda z tych pętli zawiera odpowiednio 45 i 60 reszt aminokwasowych..
Homologiczne sekwencje typu III odpowiadają 90 aminokwasom ułożonym w sposób liniowy i bez wewnętrznych mostków dwusiarczkowych. Jednak niektóre z wewnętrznych aminokwasów homologicznych sekwencji typu III mają wolne grupy siarkowodorowe (R-S-H).
Trzy homologiczne sekwencje fałdują się i organizują w mniej lub bardziej liniowej matrycy, tworząc dwa „dimeryczne ramiona” z prawie identycznymi podjednostkami białka. Różnice między dwiema podjednostkami wynikają z potranskrypcyjnych zdarzeń dojrzewania.
Fibronektyny można ogólnie zobaczyć na dwa sposoby. Forma otwarta, którą obserwuje się, gdy osadzają się na powierzchni membrany i są gotowe do wiązania się z jakimś innym składnikiem na zewnątrz komórki. Ten kształt można zobaczyć tylko pod mikroskopem elektronowym..
Inną formę można zobaczyć w roztworach fizjologicznych. Końce każdego ramienia lub przedłużenia są zagięte w kierunku środka białka, łącząc się przez końce karboksylowe miejsc wiązania kolagenu. W tej postaci białko ma wygląd kulisty.
Domeny i właściwości „multi-adhezji”
Właściwości multoadhezyjne fibronektyny wynikają z obecności różnych domen, które mają wysokie wartości powinowactwa do różnych substratów i białek..
„Ramiona dimeryczne” można podzielić na 7 różnych domen funkcjonalnych. Są one klasyfikowane według substratu lub domeny, z którą każdy się wiąże. Na przykład: Domena 1 i Domena 8 to domeny wiążące białko fibryny.
Domena 2 ma właściwości wiązania kolagenu, domena 6 jest regionem adhezji komórki, to znaczy umożliwia jej zakotwiczenie się na prawie każdej błonie lub zewnętrznej powierzchni komórek. Funkcje domen 3 i 5 są nadal nieznane.
W domenie 9 znajduje się koniec karboksylowy lub koniec C białka. Regiony adhezyjne komórek domeny 6 posiadają tripeptyd składający się z sekwencji aminokwasów Arginina-Glicyna-Asparagina (Arg-Gly-Asp).
Ten tripeptyd jest wspólny dla kilku białek, takich jak kolagen i integryny. Jest to minimalna struktura wymagana do rozpoznania błony komórkowej przez fibronektyny i integryny..
Fibronektyna w postaci kulistej reprezentuje rozpuszczalną i wolną postać we krwi. Jednak na powierzchni komórek iw macierzy pozakomórkowej występuje w postaci „otwartej”, sztywnej i nierozpuszczalnej..
funkcje
Niektóre z procesów, w których wyróżnia się udział fibronektyn, to przyleganie do komórki, przyczepianie się, łączenie lub przyleganie komórek do osocza lub błon podstawnych, stabilizacja skrzepów krwi i gojenie się ran..
Komórki przylegają do określonego miejsca na fibronektynie poprzez białko receptorowe znane jako „integryna”. To białko przenika przez błonę plazmatyczną do wnętrza komórki.
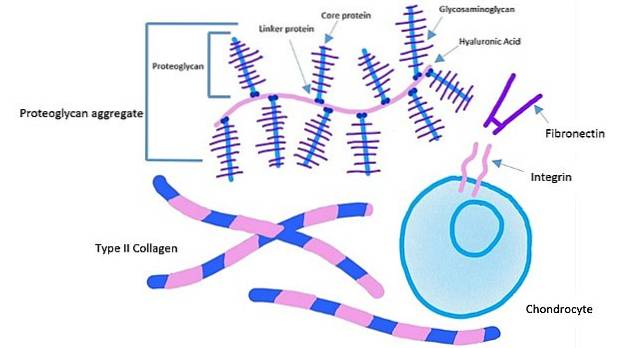
Domena zewnątrzkomórkowa integryn wiąże się z fibronektyną, podczas gdy domena wewnątrzkomórkowa integryn jest przyłączona do włókien aktynowych. Ten rodzaj zakotwiczenia umożliwia przenoszenie napięcia wytworzonego w macierzy zewnątrzkomórkowej na cytoszkielet komórek..
Fibronektyny uczestniczą w procesie gojenia się ran. Te w swojej rozpuszczalnej postaci odkładają się na włóknach kolagenowych sąsiadujących z raną, pomagając w migracji fagocytów, fibroblastów i proliferacji komórek w otwartej ranie..
Właściwy proces gojenia rozpoczyna się, gdy fibroblasty „spinają” sieć fibronektyny. Ta sieć działa jako rodzaj rusztowania lub wsparcia dla odkładania nowych włókien kolagenowych, siarczanu heparanu, proteoglikanu, chondrotin sultafo i innych składników macierzy zewnątrzkomórkowej, które są niezbędne do naprawy tkanki..
Fibronektyna bierze również udział w ruchu komórek naskórka, ponieważ poprzez tkankę ziarnistą pomaga w reorganizacji błony podstawnej znajdującej się pod naskórkiem w tkankach, co sprzyja powstawaniu rogowacenia..
Wszystkie fibronektyny pełnią podstawowe funkcje dla wszystkich komórek; uczestniczą w procesach tak różnorodnych, jak migracja i różnicowanie komórek, homeostaza, gojenie się ran, fagocytoza.
Bibliografia
- Conde-Agudelo, A., Romero, R. i Roberts, J. M. (2015). Testy przewidujące stan przedrzucawkowy. W zaburzeniach nadciśnieniowych Chesleya w ciąży (str. 221-251). Academic Press.
- Farfán, J. Á. L., Tovar, H. B. S., de Anda, M. D. R. G., & Guevara, C. G. (2011). Fibronektyna płodu i długość szyjki macicy jako wczesne czynniki prognostyczne przedwczesnego porodu. Gynecology and Obstetrics of Mexico, 79 (06), 337-343.
- Feist, E. i Hiepe, F. (2014). Autoprzeciwciała przeciwko fibronektynie. W autoprzeciwciałach (str. 327-331). Elsevier.
- Letourneau, P. (2009). Aksonalne poszukiwanie ścieżki: rola macierzy zewnątrzkomórkowej. Encyclopedia of neuroscience, 1, 1139-1145.
- Pankov, R., & Yamada, K. M. (2002). Fibronektyna w skrócie. Journal of cell science, 115 (20), 3861-3863.
- Proctor, R. A. (1987). Fibronektyna: krótki przegląd jej struktury, funkcji i fizjologii. Recenzje chorób zakaźnych, 9 (Suplement_4), S317-S321.



Jeszcze bez komentarzy