
Struktura fluorku litu, właściwości, otrzymywanie, zastosowania

Plik fluorek litu jest to nieorganiczne ciało stałe, którego wzór chemiczny to LiF. Składa się z jonów Li+ i F.- które są połączone wiązaniem jonowym. Występuje w niewielkich ilościach w różnych minerałach, zwłaszcza w krzemianach, takich jak lepidolit, w wodzie morskiej i wielu studniach mineralnych.
Jest szeroko stosowany w urządzeniach optycznych ze względu na jego przezroczystość w szerokim zakresie długości fal, od widma podczerwieni (IR) do ultrafioletowego UV, poprzez widzialne.

Został również wykorzystany w urządzeniach do wykrywania niebezpiecznego promieniowania w miejscach pracy, w których ludzie są na nie narażeni przez krótki czas. Ponadto jest używany jako materiał do topienia aluminium lub do produkcji szkieł do soczewek lub okularów oraz do produkcji ceramiki..
Służy jako materiał do powlekania elementów akumulatorów litowo-jonowych i zapobiega początkowej utracie ładunku z akumulatorów.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Współczynnik załamania światła
- 3.7 Rozpuszczalność
- 3.8 Inne właściwości
- 4 Zbieranie i lokalizacja
- 5 zastosowań
- 5.1 W zastosowaniach optycznych
- 5.2 W detektorach jonizującego lub niebezpiecznego promieniowania
- 5.3 Jako materiał do preliteracji katody baterii litowych
- 5.4 W różnych zastosowaniach
- 6 Odnośniki
Struktura
Fluorek litu jest związkiem jonowym, to znaczy utworzonym przez połączenie kationu litu+ i anion F-. Siła, która utrzymuje je razem, jest elektrostatyczna i nazywana jest wiązaniem jonowym..
Kiedy lit się łączy, oddaje elektron do fluoru, pozostawiając oba w bardziej stabilnej formie niż początkowa, jak wyjaśniono poniżej.
Element litowy ma następującą konfigurację elektroniczną: [He] 1sdwa 2s1 a podczas przenoszenia elektronu struktura elektronowa wygląda następująco: [He] 1sdwa który jest znacznie bardziej stabilny.
Pierwiastek fluoru, którego konfiguracja elektroniczna to: [Ne] 1sdwa 2sdwa 2 P5, przyjmując elektron pozostaje on w postaci [Ne] 1sdwa 2sdwa 2 P6, bardziej stabilny.
Nomenklatura
- Fluorek litu
- Fluorolit
- Monofluorek litu
Nieruchomości
Stan fizyczny
Białe ciało stałe, które krystalizuje w strukturze sześciennej, jak chlorek sodu NaCl.
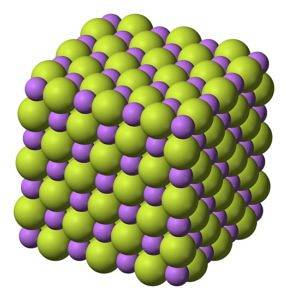
Waga molekularna
26 g / mol
Temperatura topnienia
848,2 ° C
Temperatura wrzenia
1673 ° C, chociaż ulatnia się w temperaturze 1100-1200 ° C
Gęstość
2640 g / cm3
Współczynnik załamania światła
1.3915
Rozpuszczalność
Słabo rozpuszczalny w wodzie: 0,27 g / 100 g wody o temperaturze 18 ºC; 0,134 g / 100 g w temperaturze 25 ° C Rozpuszczalny w środowisku kwaśnym. Nierozpuszczalny w alkoholu.
Inne właściwości
Jego opary zawierają formy dimeryczne (LiF)dwa i trimeryczny (LiF)3. Z kwasem fluorowodorowym HF tworzy wodorofluorek litu LiHFdwa; z wodorotlenkiem litu tworzy podwójną sól LiF.LiOH.
Zbiór i lokalizacja
Fluorek litu LiF można otrzymać w reakcji kwasu fluorowodorowego HF z wodorotlenkiem litu LiOH lub węglanem litu LidwaWSPÓŁ3.
Jednak występuje w niewielkich ilościach w niektórych minerałach, takich jak lepidolit, oraz w wodzie morskiej..

Aplikacje
W zastosowaniach optycznych
LiF jest stosowany w postaci zwartych kryształów w spektrofotometrach podczerwieni (IR) ze względu na doskonałą dyspersję, którą prezentują w zakresie długości fal od 4000 do 1600 cm-1.
Z nasyconych roztworów tej soli otrzymuje się duże kryształy LiF. Może zastąpić naturalne kryształy fluorytu w różnego rodzaju aparatach optycznych.
Duże, czyste kryształy są stosowane w układach optycznych do promieniowania ultrafioletowego (UV), widzialnego i IR oraz w monochromatorach rentgenowskich (0,03-0,38 nm).

Jest również stosowany jako materiał do powlekania optycznego obszaru UV ze względu na jego szerokie pasmo optyczne, większe niż w przypadku innych fluorków metali..
Jego przezroczystość w dalekim UV (90-200 nm) sprawia, że idealnie nadaje się jako powłoka ochronna na zwierciadłach aluminiowych (Al). Lustra LiF / Al są używane w systemach teleskopów optycznych do zastosowań w kosmosie.
Powłoki te uzyskuje się poprzez fizyczne osadzanie z fazy gazowej i osadzanie warstw na poziomie atomowym..
W detektorach jonizującego lub niebezpiecznego promieniowania
Fluorek litu jest szeroko stosowany w detektorach termoluminescencyjnych do promieniowania fotonowego, neutronowego i cząstek β (beta)..
Detektory termoluminescencyjne oszczędzają energię promieniowania, gdy są na nie narażone. Później po podgrzaniu uwalniają zmagazynowaną energię w postaci światła..
W tym zastosowaniu LiF jest zazwyczaj domieszkowany domieszkami magnezu (Mg) i tytanu (Ti). Zanieczyszczenia te generują pewne poziomy energii, które działają jak dziury, w których uwięzione są elektrony uwolnione przez promieniowanie. Gdy materiał jest następnie podgrzewany, elektrony te wracają do swojego pierwotnego stanu energetycznego, emitując światło.
Natężenie emitowanego światła zależy bezpośrednio od energii pochłoniętej przez materiał.
Termoluminescencyjne detektory LiF przeszły pomyślnie testy do pomiaru złożonych pól promieniowania, takich jak te obecne w Wielkim Zderzaczu Hadronów lub LHC. Wielki Zderzacz Hadronów), z siedzibą w Europejskiej Organizacji Badań Jądrowych, znanej jako CERN (od francuskiego akronimu) Conseil Européen pour la Recherche Nucléaire).
Promieniowanie w eksperymentach przeprowadzonych w tym ośrodku badawczym przedstawia hadrony, neutrony i elektrony / pozytrony, wśród innych typów cząstek subatomowych, z których wszystkie można wykryć za pomocą LiF.
Jako materiał do preliteracji katody baterii litowych
LiF został pomyślnie przetestowany w postaci nanokompozytów z kobaltem (Co) i żelazem (Fe) jako materiałami do wstępnego inicjowania. prelitacja) materiału katody akumulatorów litowo-jonowych.
Podczas pierwszego cyklu ładowania lub etapu tworzenia baterii litowo-jonowej elektrolit organiczny rozkłada się, tworząc fazę stałą na powierzchni anody..
Proces ten zużywa lit z katody i zmniejsza energię o 5 do 20% całkowitej pojemności akumulatora litowo-jonowego..
Z tego powodu zbadano elektrochemiczne wstępne inicjowanie katody, które powoduje elektrochemiczną ekstrakcję litu z nanokompozytu, który działa jak donor litu, unikając w ten sposób zużycia litu z katody..
Nanokompozyty LiF / Co i LiF / Fe mają dużą zdolność oddawania litu do katody, są łatwe w syntezie, stabilne w warunkach środowiskowych i przetwarzaniu baterii.

W różnych zastosowaniach
Fluorek litu jest stosowany jako topnik spawalniczy, zwłaszcza aluminium, oraz w powłokach prętów spawalniczych. Stosowany również w ogniwach redukcyjnych aluminium.
Jest szeroko stosowany w produkcji okularów (takich jak soczewki), w których współczynnik rozszerzalności maleje. Znajduje również zastosowanie w produkcji ceramiki. Ponadto jest używany do produkcji emalii i lakierów szklistych..
LiF jest składnikiem paliw rakietowych i paliw do niektórych typów reaktorów..
LiF jest również stosowany w diodach elektroluminescencyjnych lub elementach fotowoltaicznych do wprowadzania elektronów do warstw wewnętrznych.
Bibliografia
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- NAS. National Library of Medicine. (2019). Fluorek litu. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Obryk, B. i in. (2008). Reakcja różnych typów detektorów fluorku litu TL na wysokoenergetyczne mieszane pola promieniowania. Pomiary promieniowania 43 (2008) 1144-1148. Odzyskany z sciencedirect.com.
- Sun, Y. i in. (2016). Synteza chemiczna nanokompozytu fluorku litu / metalu in situ do wstępnego litowania katod o dużej wydajności. Nano Letters 2016, 16, 2, 1497-1501. Odzyskany z pubs.acs.org.
- Hennessy, J. i Nikzad, S. (2018). Osadzanie warstw atomowych powłok optycznych z fluorku litu w ultrafiolecie. Inorganics 2018, 6, 46. Odzyskany z mdpi.com.
Jeszcze bez komentarzy